Абстрактный
Предыстория:
С момента первого упоминания о применении марихуаны в китайской фармакопее в 2600 году до н. э. ей стали приписывать многочисленные физические, психологические и эмоциональные преимущества. Фитоканнабиноиды, каннабидиол (КБД) и дельта-9-тетрагидроканнабинол (Δ9-ТГК), являются наиболее изученными экстрактами из cannabis sativa — подвида конопли и марихуаны. КБД и Δ9-ТГК уникальным образом взаимодействуют с эндоканнабиноидной системой (ЭКС). Благодаря прямому и косвенному воздействию эндоканнабиноиды и фитоканнабиноиды растительного происхождения модулируют и влияют на различные физиологические системы, на которые воздействует эндоканнабиноидная система.
Methods:
In 1980, Cunha et al. reported anticonvulsant benefits in 7/8 subjects with medically uncontrolled epilepsy using marijuana extracts in a phase I clinical trial. Since then neurological applications have been the major focus of renewed research using medical marijuana and phytocannabinoid extracts.
Результаты:
В последнее время фитоканнабиноиды используются в неврологии в качестве вспомогательного средства при лечении злокачественных опухолей головного мозга, болезни Паркинсона, болезни Альцгеймера, рассеянного склероза, нейропатической боли, а также детских эпилептических синдромов Леннокса — Гасто и Драве. Кроме того, фитоканнабиноиды изучаются в качестве средства для лечения психических расстройств и расстройств настроения, таких как шизофрения, тревожность, депрессия, зависимость, постконтузионный синдром и посттравматические стрессовые расстройства.
Выводы:
В этом обзоре мы представим данные исследований на животных и людях о текущем клиническом применении КБД отдельно и в сочетании с Δ9-ТГК. Мы расскажем о нейропротекторных, противовоспалительных и иммуномодулирующих свойствах фитоканнабиноидов и их применении при различных клинических синдромах.
Введение
С тех пор как в 2600 году до н. э. впервые появились упоминания о марихуане (например, в китайской фармакопее), ей стали приписывать многочисленные физические, психологические и эмоциональные преимущества. К фитоканнабиноидам, каннабидиолу (КБД) и дельта-9-тетрагидроканнабинолу (Δ9-ТГК), наиболее изученным экстрактам подвида cannabis sativa, относятся конопля и марихуана. В последнее время его успешно применяют в качестве вспомогательного средства при лечении злокачественных опухолей головного мозга, болезни Паркинсона (БП), болезни Альцгеймера (БА), рассеянного склероза (РС), нейропатической боли, а также при детских судорожных расстройствах, синдромах Леннокса — Гасто и Драве. В этом обзоре мы приводим данные исследований на животных и людях о текущем клиническом/неврологическом применении КБД отдельно или в сочетании с Δ9-ТГК, подчеркивая его нейропротекторные, противовоспалительные и иммуномодулирующие свойства при использовании в различных клинических ситуациях.
Открытие эндоканнабиноидной системы
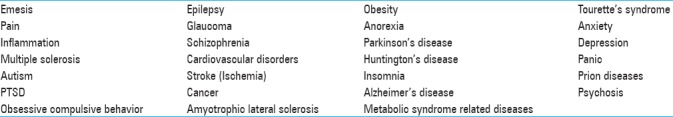
Фармакология каннабиноидных рецепторов начала развиваться в конце 1960-х годов, когда был выделен и синтезирован Δ9-ТГК, который оказался основным психоактивным компонентом марихуаны. [40,80,81,105] Открытие в начале 1990-х годов специфических мембранных рецепторов для Δ9-ТГК привело к выявлению эндогенной сигнальной системы, которая теперь известна как эндоканнабиноидная система (ЭКС). Вскоре после этого были идентифицированы эндоканнабиноиды N-арахидоноилэтаноламин (анандамид) и 2-арахидоноилглицерин (2-AG). Эндоканнабиноидная система состоит из двух основных типов эндоканнабиноидных рецепторов, связанных с G-белком (CB1 и CB2), которые расположены в головном мозге млекопитающих, а также в центральной и периферической нервной системе, включая ткани, связанные с иммунной системой. Рецепторы CB1 и CB2 могут сосуществовать в различных концентрациях в одних и тех же местах.[86] Как фитоканнабиноиды, так и эндогенные каннабиноиды действуют как ретроградные мессенджеры, обеспечивая ингибирование как возбуждающей, так и тормозной передачи в мозге посредством активации пресинаптических рецепторов CB1. Манипуляции с ферментами, разлагающими эндоканнабиноиды, рецепторами CB1 и CB2 и их эндогенными лигандами показали многообещающие результаты в модуляции многочисленных процессов, связанных с нейродегенеративными заболеваниями, раком, эпилепсией и черепно-мозговыми травмами [Таблица 1]. Кроме того, известно, что ECS влияет на нейропластичность, апоптоз, эксайтотоксичность, нейровоспаление и нарушение мозгового кровообращения, связанные с инсультом и травмой.[105]
Таблица 1.
Состояния и заболевания, при которых активация ЭНС приносит пользу[78]
Фитоканнабиноиды КБД и Δ9-ТГК
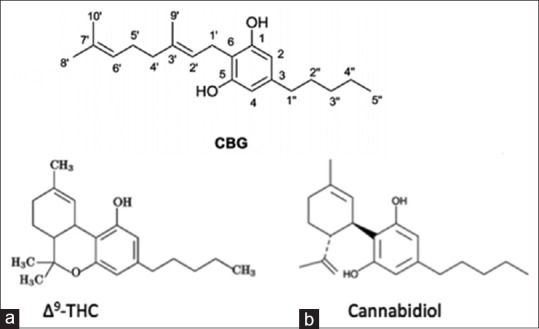
Помимо фитоканнабиноида Δ9-ТГК, растение каннабис содержит более 400 химических веществ, из которых более 60 являются фитоканнабиноидами. Некоторые из этих веществ воздействуют исключительно на рецепторы CB1 и CB2 по отдельности и одновременно, а также подавляют или активируют функции рецепторов. КБД, как и Δ9-ТГК, является основным фитоканнабиноидом, на долю которого приходится до 40 % экстракта растения. КБД был впервые обнаружен в 1940 году, более чем за 20 лет до открытия Δ9-ТГК. [104,105] До недавнего времени в исследованиях каннабиса доминировал Δ9-ТГК. Все классы фитоканнабиноидных соединений, содержащихся в марихуане и конопле, включая Δ9-ТГК и КБД, образуются в результате различных изменений базовой молекулярной структуры соединений типа каннабигерола [Рисунок 1].[34,49]
Рисунок 1.
Каннабиноидные рецепторы
Фитоканнабиноидные соединения и экстракты могут быть получены как из конопли, так и из подвидов марихуаны, включая КБД. КБД не вызывает тех же психоактивных эффектов, что и Δ9-ТГК (то есть люди, употребляющие КБД, не испытывают эйфории). Различные психоактивные эффекты, обычно связанные с Δ9-ТГК, обусловлены активацией каннабиноидного рецептора CB1, который в большом количестве содержится в мозге. Наибольшая плотность рецепторов CB1 наблюдается в выходных ядрах базальных ганглиев, ретикулярной части чёрной субстанции (SNr), а также во внутреннем и внешнем сегментах бледного шара (часть мозга, которая регулирует произвольные движения).[88] В гиппокампе, особенно в зубчатой извилине, и в мозжечке также наблюдается высокая плотность рецепторов CB1. В стволе мозга очень мало рецепторов CB1. Эти данные указывают на то, что рецепторы CB1 участвуют в модуляции памяти, эмоций, боли и движений. [37,90] Было доказано, что Δ9-THC, воздействующий на рецепторы CB1, снижает ноцицепцию у животных с острой, висцеральной, воспалительной и хронической болью. В исследованиях с участием пациентов с хронической и нейропатической болью употребление марихуаны или экстрактов каннабиноидов приводило к положительным результатам и улучшению симптомов. [52,95]
Активация рецепторов CB1 в нейронах
Активация рецепторов CB1 в нейронах приводит к ингибированию аденилатциклазы и снижению высвобождения нейромедиаторов за счёт блокады потенциалзависимых кальциевых каналов. [46,65,125] Активация этих сигнальных путей рецепторами CB1 и высокое содержание этих рецепторов в пресинаптических окончаниях указывают на то, что эндоканнабиноидная стимуляция рецепторов CB1 подавляет возбудимость нейронов и нейротрансмиссию. Эти эффекты привели к изучению фитоканнабиноидов в качестве средства для лечения эпилепсии. Несколько фармацевтических компаний пытаются разработать синтетические высокоаффинные антагонисты CB1 и обратные агонисты в качестве терапевтических препаратов для лечения диабета, метаболического синдрома и лекарственной зависимости.[9,42]
Рецептор CB2
Рецептор CB2, в отличие от CB1, не так сильно выражен в центральной нервной системе (ЦНС). Влияние Δ9-ТГК на иммунную функцию связывают с взаимодействием с каннабиноидными рецепторами CB2, которые преимущественно находятся в иммунных клетках.[54] Рецепторы CB2 широко распространены в основных тканях, отвечающих за выработку и регуляцию иммунных клеток, включая селезёнку, миндалины и тимус.[89] К этим клеточным линиям относятся В- и Т-лимфоциты, естественные киллеры, моноциты, макрофаги, клетки микроглии и тучные клетки. Как и в случае с рецепторами CB1, стимуляция эндоканнабиноидами подавляет нейротрансмиссию через рецепторы CB2.
Культурные микроглиальные тельца
Исследование культивируемых клеток микроглии показало, что интерферон-c и гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ), известные как активаторы воспалительной реакции микроглиальных клеток, сопровождаются значительным повышением уровня рецепторов CB2.[73] Это позволяет предположить, что рецепторы CB2 играют важную роль в функционировании микроглиальных клеток при воспалительной реакции в ЦНС. Активация CB2 была вовлечена в несколько нейродегенеративных заболеваний, таких как болезнь Хантингтона (HD) и AD.[21,67,98] Повышенная экспрессия CB2 в головном мозге была подтверждена с помощью CB2-селективной позитронно-эмиссионной томографии (ПЭТ) на моделях мышей с болезнью Альцгеймера. Эта повышенная экспрессия сопровождалась образованием бета-амилоидных бляшек, что указывает на потенциальную полезность ПЭТ-индикаторов CB2 в качестве диагностического метода для выявления начала нейровоспаления.
Уникальные механизмы действия CBD
Взаимодействие КБД с рецепторами CB2 более сложное, но, как и в случае с Δ9-THC, считается, что КБД снижает воспалительную реакцию. Воздействие КБД на рецептор CB2 — это лишь один из нескольких механизмов, с помощью которых КБД может влиять на нейровоспаление [Таблица 2]. Поскольку и CBD, и Δ9-THC модулируют активность рецепторов, связанных с G-белком, связанных с эндоканнабиноидной системой, и CBD может функционировать как частичный агонист и противодействует Δ9-THC, CBD в более высоких дозах может в некоторой степени противодействовать психоактивному эффекту Δ9-THC.[77] Как ни странно, этот эффект отмечают многие потребители каннабиса, которые одновременно принимают CBD.
Таблица 2.
Текущие исследования указывают на широкий спектр клеточных механизмов, связанных с КБД и ЭНС. К конкретным клеточным мишеням относятся нейроны, эндотелиальные клетки, олигодендроциты и клетки микроглии [12,78,92,108]
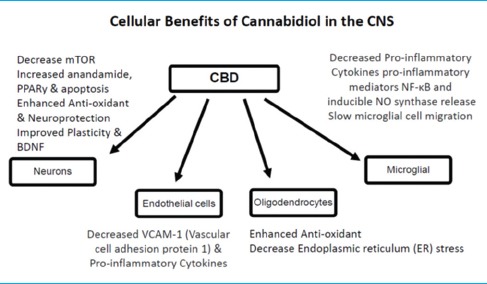
Молекулярные мишени CBD
Молекулярные мишени КБД, в том числе каннабиноидные и неканнабиноидные рецепторы, ферменты, переносчики и белки клеточного поглощения, помогают объяснить низкую аффинность КБД к каннабиноидным рецепторам CB1 и CB2. На животных моделях КБД продемонстрировал способность уменьшать повреждения головного мозга, связанные с нейродегенеративными и/или ишемическими состояниями за пределами энкантомерной системы. КБД, по-видимому, стимулирует синаптическую пластичность и способствует нейрогенезу, что может объяснять его положительное влияние на ослабление психотических, тревожных и депрессивных состояний. Механизмы, лежащие в основе этих эффектов, включают множество клеточных мишеней для повышения уровней нейротропного фактора головного мозга (BDNF), снижения активации микроглии и снижения уровней провоспалительных медиаторов.[82,122,123]
КБД очень малотоксичен для человека
В отличие от психоактивных свойств, связанных с Δ9-ТГК, КБД, как было доказано, обладает очень низкой токсичностью для людей и других биологических видов (см. раздел «Безопасность»). После попадания в организм и абсорбции КБД быстро распространяется и благодаря своей липофильной природе легко проникает через гематоэнцефалический барьер. Период полувыведения КБД составляет около 9 часов, и он преимущественно выводится с мочой в свободной форме и в форме глюкуронида.[78]
Исследование эндоканнабиноидной системы
Исследования эндоканнабиноидной системы активно продолжаются, и в этой области сделано множество открытий. Эндоканнабиноиды, фитоканнабиноиды и синтетические фармакологические средства, воздействующие на различные элементы эндоканнабиноидной системы, потенциально могут влиять на широкий спектр патологий, включая нарушения пищевого поведения, хроническую боль, рвоту, бессонницу, глаукому, глиомы, непроизвольные двигательные расстройства, инсульт и психические заболевания, такие как депрессия, аутизм и шизофрения.[68] Исследования роли эндокринной системы в реакции на стресс показали, что она оказывает значительное влияние на гипоталамо-гипофизарно-надпочечниковую систему, контроль репродуктивной функции за счёт изменения выработки гонадотропинов, фертильность и сексуальное поведение.
Остальные разделы будут посвящены ECS и эффектам фитоканнабиноидов, CBD и Δ9-THC, на нейровоспаление, нейропротекцию и их потенциальное использование при лечении специфических неврологических расстройств, включая травмы, затрагивающие ЦНС.[106] Цитируемое исследование будет включать примеры клинических преимуществ КБР отдельно и в комбинации с Δ9-ТГК.[12,84]
Нейропротекторные свойства фитоканнабиноидов
Исследования КБД на животных моделях и людях показали, что он обладает многочисленными терапевтическими свойствами, влияющими на работу и защиту мозга, как за счёт прямого воздействия на эндоканнабиноидную систему, так и за счёт влияния на эндогенные каннабиноиды. В целом КБД продемонстрировал анксиолитические, антидепрессивные, нейропротекторные, противовоспалительные и иммуномодулирующие свойства. КБД снижает выработку воспалительных цитокинов, влияет на микроглиальные клетки, возвращая их в разветвлённое состояние, сохраняет мозговое кровообращение во время ишемических событий и уменьшает сосудистые изменения и нейровоспаление.[12]
Другие эффекты CBD
Другие эффекты КБД включают ингибирование транспорта кальция через мембраны, ингибирование поглощения и ферментативного гидролиза анандамида, а также ингибирование экспрессии индуцибельного NO-синтазы белка и активации ядерного фактора (NF)-κB. КБД повышает уровень аденозина в мозге, снижая обратный захват аденозина. Повышенный уровень аденозина связан с нейропротекцией и уменьшением воспаления после травмы головного мозга.[7,16] Также известно, что CBD оказывает сосудистое действие, вызывая расширение сосудов, а также гипотензию, которые могут быть перспективными в качестве средства защиты от повреждения сосудов головного мозга, связанного с инсультом.[53,105] CBD обладает несколькими свойствами, которые могут быть использованы для лечения БА, включая предотвращение вызванной глутаматом эксайтотоксичности, снижение уровня провоспалительных медиаторов и способность поглощать активные формы кислорода (АФК) и снижать перекисное окисление липидов.[16,32,48,59]
Экспериментальное взаимодействие каннабиноидных рецепторов in vitro
Экспериментально in vitro было доказано, что взаимодействие каннабиноидных рецепторов с КБД и Δ9-ТГК, как вместе, так и по отдельности, обеспечивает защиту нейронов от эксайтотоксичности, гипоксии и недостатка глюкозы. In vivo каннабиноиды уменьшают потерю нейронов в гиппокампе и объём инфаркта после церебральной ишемии, острой черепно-мозговой травмы и индуцированной эксайтотоксичности. Эти эффекты были приписаны ингибированию передачи глутамата, уменьшению поступления кальция, снижению активации микроглии и последующему ингибированию вредных каскадов, таких как выработка фактора некроза опухоли альфа и окислительный стресс.[92]
Дельта-9-ТГК
Δ9-ТГК может усиливать действие нейромедиатора серотонина, снижая нейротрансмиссию через рецепторы 5-HT3. Это может способствовать фармакологическому действию, направленному на уменьшение тошноты. Этот эффект можно обратить вспять при более высоких дозах или при хроническом употреблении Δ9-ТГК.[103,117] Синтетические аналоги Δ9-ТГК, набилон (Cesamet, Valeant Pharmaceuticals North America) и дронабинол (Marinol-Solvay Pharmaceuticals), назначаются для подавления тошноты и рвоты, вызванных химиотерапией.[87] Синтетические Δ9-ТГК используются ограниченно из-за многочисленных побочных эффектов, связанных с активацией рецептора CB1 в центральной нервной системе.
Нейропротекторное действие дельта-9-ТГК
Также было доказано, что Δ9-ТГК защищает мозг от различных повреждений нейронов и облегчает симптомы нейродегенерации у животных с рассеянным склерозом, болезнью Паркинсона, болезнью Гентингтона, боковым амиотрофическим склерозом (БАС) и болезнью Альцгеймера[23,35,41]. Как и КБД, Δ9-ТГК может оказывать защиту, не связанную с ЭСТ, за счёт прямого воздействия на нейронные клетки и ненейронные элементы мозга. Механизмы включают в себя модуляцию возбуждающих глутаматергических передач и синаптической пластичности, модуляцию иммунных реакций, высвобождение противовоспалительных медиаторов, модуляцию возбудимости N-метил-D-аспартатных рецепторов и их влияние на щелевые контакты, кальций и антиоксиданты.[70]
Нейродегенеративные заболевания
Обзор
Нейродегенеративные заболевания включают в себя большую группу состояний, связанных с прогрессирующей гибелью нейронов, что приводит к различным клиническим проявлениям. Гистоморфологические изменения могут включать глиоз и пролиферацию микроглии, а также образование агрегатов неправильно свернутых или аномальных белков. К наиболее распространенным нейродегенеративным заболеваниям относятся болезнь Альцгеймера, боковой амиотрофический склероз, деменция с тельцами Леви и болезнь Паркинсона.
Многочисленные способы применения КБД и дельта-9-ТГК при нейродегенеративных заболеваниях
Изучается возможность применения КБД и Δ9-ТГК для лечения нейродегенеративных заболеваний как для облегчения симптомов, так и для устранения патологических изменений в тканях нейронов. И КБД, и Δ9-ТГК могут действовать как агонисты и антагонисты в отношении различных рецепторов эндоканнабиноидной системы. Кроме того, как эндогенные, так и фитоканнабиноиды могут воздействовать на широкий спектр рецепторов, не относящихся к эндоканнабиноидной системе. [31,92,116]
Нейропротекция при БА
Для болезни Альцгеймера характерно повышенное отложение бета-амилоидного пептида, а также активация глии в сенильных бляшках, избирательная потеря нейронов и когнитивные нарушения. Каннабиноиды защищают от эксайтотоксичности in vitro и у пациентов с острым повреждением головного мозга. У пациентов с болезнью Альцгеймера клеточные исследования сенильных бляшек показали экспрессию каннабиноидных рецепторов CB1 и CB2, а также маркеров активации микроглии. Однако количество CB1-положительных нейронов в норме больше, чем в областях активации микроглии при болезни Альцгеймера. В мозге при болезни Альцгеймера также заметно снижается взаимодействие с G-белковыми рецепторами и экспрессия белка рецептора CB1. Считается, что за продолжающийся воспалительный процесс при этом заболевании отвечает активированная микроглия, скапливающаяся в старческих бляшках.
Исследование применения каннабиноидов при болезни Альцгеймера
Исследования с применением каннабиноидов для лечения болезни Альцгеймера у животных показали, что агонизм CB1 способен предотвращать гиперфосфорилирование тау-белка в культивируемых нейронах и противодействовать клеточным изменениям и поведенческим последствиям у грызунов, вызванным β-амилоидом. Антагонисты CB2 оказывали защитное действие в экспериментах in vivo, подавляя реактивный глиоз у животных, которым вводили β-амилоид. Кроме того, они подавляли вызванную болезнью Альцгеймера активацию микроглии и гибель нейронов. Каннабиноидные соединения подавляют вызванную болезнью Альцгеймера активацию культивируемых клеток микроглии, о чём свидетельствуют митохондриальная активность, морфология клеток и высвобождение фактора некроза опухоли. [60,92] Кроме того, было доказано, что Δ9-ТГК снижает возбудимость, характерную для пациентов с тяжёлой формой болезни Альцгеймера. [121]
Каннабидиол
КБД эффективен в экспериментальной модели паркинсонизма (у крыс с поражением 6-гидроксидофамином) благодаря антиоксидантному действию, не зависящему от каннабиноидных рецепторов.[46] Он ослабляет дистонию, связанную с болезнью Паркинсона, но не тремор,[47] что согласуется с положительной корреляцией между уровнем КБД в скорлупе и бледном шаре у тех, кто употребляет каннабис в рекреационных целях.[50]
У крыс, которым вводили 3-нитропропионовую кислоту — токсин, ингибирующий цикл трикарбоновых кислот в митохондриях, что приводит к прогрессирующему ухудшению двигательной активности, как у пациентов с болезнью Гентингтона, — КБД уменьшает атрофию полосатого тела, не зависящую от активации каннабиноидных аденозиновых рецепторов A2A.[100] Напротив, КБД сам по себе не обеспечивал защиту у крыс, которым вводили малонат.[99] Клиническое исследование, проведённое в 1991 году с участием 15 пациентов с болезнью Гентингтона, показало, что средняя суточная доза КБД в 10 мг/кг/день на одного пациента в течение 6 недель была безопасной, но не приводила к значительному облегчению симптомов.[51] Препарат на основе фитоканнабиноидов Sativex®, представляющий собой комбинацию КБД и Δ9-ТГК в соотношении 1:1, оказывает нейропротекторное действие за счёт механизма, опосредованного CB1 и CB2, на модели болезни Гентингтона. [115]
КБД и, в меньшей степени, Δ9-ТГК могут оказывать как прямое, так и косвенное воздействие на изоформы рецепторов, активируемых пролифераторами пероксисом (PPAR α, β и γ). Активация PPAR, наряду с CB1 и CB2, опосредует многочисленные обезболивающие, нейропротекторные, модулирующие функции нейронов, противовоспалительные, метаболические, противоопухолевые, желудочно-кишечные и сердечно-сосудистые эффекты как в энтеральной нервной системе, так и за её пределами. Кроме того, агонисты PPAR-γ (гамма) используются для лечения гиперлипидемии и гипергликемии. PPAR-γ снижает воспалительную реакцию во многих клетках сердечно-сосудистой системы, особенно в эндотелиальных клетках, тем самым уменьшая риск развития атеросклероза. Фитоканнабиноиды могут повышать транскрипционную активность и оказывать воздействие, которое подавляется селективными антагонистами PPAR-γ, тем самым увеличивая выработку эндоканнабиноидов. [33]
КБД также участвует в модуляции различных рецепторов за пределами эндорфиновой системы. Серотониновые рецепторы участвуют в терапевтическом эффекте КБД. На модели крыс было показано, что КБД стимулирует нейрогенез в гиппокампе. Нейропротекторный эффект КБД при гипоксически-ишемическом повреждении головного мозга связан с аденозиновыми рецепторами A2. Активация аденозиновых рецепторов КБД может усиливать передачу сигналов аденозина, обеспечивая противовоспалительный и иммуносупрессивный эффект. На крысиной модели болезни Альцгеймера КБД ослаблял эффекты реактивного глиоза и последующей нейротоксичности, вызванной β-амилоидом.
Дельта-9-ТГК
На животной модели болезни Альцгеймера лечение Δ9-ТГК (3 мг/кг) один раз в день в течение 4 недель в сочетании с ингибитором ЦОГ-2 уменьшило количество бета-амилоидных бляшек и дегенерировавших нейронов. Δ9-ТГК используется для контроля симптомов болезни Альцгеймера. Лечение дронабинолом (синтетическим аналогом Δ9-ТГК) в дозе 2,5 мг в день в течение 2 недель значительно улучшило общий показатель по нейропсихиатрическому опроснику в отношении возбуждения, аберрантного двигательного и ночного поведения. [121]
Рассеянный склероз
КБД и дельта-9-ТГК
Рассеянный склероз — это аутоиммунное заболевание, которое приводит к демиелинизации нейронов и последующей аномальной активности нейронов, что вызывает спастичность и нейропатическую боль. Патологические изменения при рассеянном склерозе включают нейровоспаление, эксайтотоксичность, демиелинизацию и нейродегенерацию. Эти патологические особенности схожи с другими нейродегенеративными заболеваниями, включая болезнь Альцгеймера и церебральную ишемию. Сочетание противовоспалительных, олигопротекторных и нейропротекторных соединений, воздействующих на эксайтотоксичность, может обеспечить симптоматическое и терапевтическое лечение рассеянного склероза. [44,120]
Применение препаратов на основе каннабиса при нейродегенеративных заболеваниях
Использование препаратов на основе каннабиса для лечения рассеянного склероза имеет давнюю историю, и его взаимодействие с эндоканнабиноидной системой во многом схоже с другими нейродегенеративными заболеваниями.[55] На моделях экспериментального рассеянного склероза было показано, что стимуляция рецепторов CB1 и CB2 благотворно влияет на воспалительный процесс, что подтверждает ранние выводы о том, что у людей с рассеянным склерозом снижается частота рецидивов при курении марихуаны. [22]
Заявление Американской академии неврологии о медицинской марихуане
В 2014 году Американская академия неврологии (AAN) опубликовала обзорную статью, в которой были проанализированы 34 исследования, посвящённые использованию медицинской марихуаны (в виде экстрактов, цельных растений и синтетических фитоканнабиноидов) для лечения возможных неврологических заболеваний. Авторы обзора пришли к выводу, что марихуана оказывает сильное воздействие на симптомы спастичности и связанной со спастичностью боли, за исключением нейропатической боли при использовании пероральных экстрактов каннабиса. Они сообщили о неоднозначных результатах в отношении симптомов нарушения мочеиспускания, тремора и дискинезии. Впоследствии это исследование было использовано для формирования консенсусного заявления для их сообщества. В статье они подвели итоги, основываясь на результатах проведённого исследования [Таблица 3].[66]
Таблица 3.
Выводы подкомитета Американской академии неврологии (AAN) по результатам систематического обзора медицинской марихуаны при неврологических заболеваниях, опубликованного в 2014 году[66]

Модели на животных с рассеянным склерозом, использующие дельта-9-ТГК
В моделях рассеянного склероза на животных используется аутоиммунный энцефаломиелит (ЭАЭ), который демонстрирует демиелинизацию, нейровоспаление и неврологическую дисфункцию, связанную с инфильтрацией иммунных клеток в центральную нервную систему, что характерно для этого заболевания у людей. Было показано, что в некоторых моделях спастичности при рассеянном склерозе у мышей Δ9-ТГК уменьшает спастичность и тремор. [114] Активация системы эндоканнабиноидов при рассеянном склерозе (и экспериментальном аутоиммунном энцефалите) ограничивает повреждение нейронов за счёт снижения активности каннабиноидных рецепторов, ингибирующих ГАМК-синапсы, что является защитным механизмом, снижающим эксайтотоксическое повреждение нейронов. Повышение уровня эндоканнабиноидов защищает нейроны от эксайтотоксичности и оказывает терапевтический эффект в мышиной модели рассеянного склероза.
Испытания Δ9-ТГК на людях при рассеянном склерозе
До сих пор результаты испытаний на людях с рассеянным склерозом были неоднозначными при использовании только 9-ТГК. В ходе 15-недельного исследования с применением переносимой дозы 9-ТГК у испытуемых наблюдалось уменьшение недержания мочи, а 12-месячное наблюдение показало антиспастический эффект. [3,36] Однако последующие клинические исследования не выявили никакого влияния на прогрессирование заболевания при длительном лечении 9-ТГК. [126,127]
КБД усиливает передачу сигналов аденозина, что приводит к повышению уровня внеклеточного аденозина, а не AG-2. Нейропротекторное действие КБД при гипоксически-ишемическом повреждении головного мозга также связано с рецепторами аденозина A2. В частности, КБД уменьшает воспаление в острых моделях травм и в вирусной модели рассеянного склероза, воздействуя на аденозиновые рецепторы A2. [15,18,72,78] КБД также облегчает течение болезни, уменьшая нейровоспаление и повреждение аксонов за счёт воздействия на клетки-предшественники олигодендроцитов (OPC), которые могут дифференцироваться в новые миелинизирующие олигодендроциты. OPC очень уязвимы к воспалению и окислительному стрессу. Воспаление способствует развитию демиелинизирующих заболеваний, таких как рассеянный склероз. Исследования синтетических каннабиноидов показали, что они могут защищать OPCs, возможно, контролируя реакцию эндоплазматического ретикулума (ER) на стресс, которая модулирует реакцию на воспалительные стимулы.[79]
Положительные результаты клинических испытаний на людях, проведенных компанией GW Pharmaceuticals, позволили вывести на рынок препарат Sativex® для лечения спастичности при рассеянном склерозе в 16 странах за пределами США. Это перорально-слизистый спрей, содержащий Δ9-ТГК и КБД в соотношении 1:1. Его спазмолитические и обезболивающие свойства доказали свою эффективность при лечении пациентов с рассеянным склерозом. Способность уменьшать боль может быть связана с опосредованной каннабиноидными рецепторами регуляцией супраспинальных ГАМКергических и глутаматергических нейронов. Результаты этих исследований были приведены в обзоре Американской академии неврологии[22].
Метаанализ, проведённый в 2007 году, показал, что препараты на основе каннабиноидных рецепторов превосходят плацебо в лечении нейропатической боли, связанной с рассеянным склерозом. [58,78,93,94,121] В этом анализе были рассмотрены 18 исследований, в которых использовались Sativex® (n = 196), КБД (n = 41) и дронабинол, Marinol®, только Δ9-ТГК (n = 91). Сообщалось, что препарат Sativex® наиболее эффективно снижает нейропатическую боль на 1,7 ± 0,7 балла (P = 0,018) по шкале от 0 до 10. КБД 1,5 ± 0,7 (P = 0,044), дронабинол 1,5 ± 0,6 (P = 0,013) показали немного худшие результаты, а все каннабиноиды в совокупности — 1,6 ± 0,4 (P < 0,001) и плацебо — 0,8 ± 0,4 балла (P = 0,023). Головокружение было наиболее распространённым побочным эффектом, который чаще наблюдался при использовании буккального спрея Sativex® CBD/THC. В целом обезболивающий эффект каннабиноидов сохранялся в течение длительного времени, по крайней мере в течение 6–10 недель наблюдения.[58] В нескольких доклинических исследованиях КБД использовался для лечения спастичности и нейрогенной боли в дополнение к существующим фармакологическим методам лечения. Необходимы дальнейшие клинические исследования КБД при рассеянном склерозе.
Нейропсихиатрические заболевания и травмы мозга
Каннабидиол
КБД признан непсихоактивным фитоканнабиноидом. Однако как наблюдения за людьми, так и исследования на животных продемонстрировали широкий спектр терапевтических эффектов КБД при лечении ряда нервно-психических расстройств. КБД положительно влияет на ослабление психотических, тревожных и депрессивных проявлений. По всей видимости, это связано с тем, что КБД обеспечивает усиленную нейропротекцию и подавляет чрезмерные нейровоспалительные реакции при нейродегенеративных заболеваниях и состояниях. Общие черты, связанные с нейропротекторными механизмами, на которые влияет КБД, — окислительный стресс, иммунные медиаторы и нейротрофические факторы — также важны при таких состояниях, как посттравматическое стрессовое расстройство (ПТСР), постконтузионный синдром, депрессия и тревожность. Многие исследования подтверждают, что функция эндокринной системы заметно усиливается в ответ на патогенные события, такие как травма. Этот факт, а также многочисленные исследования на экспериментальных моделях черепно-мозговых травм подтверждают роль каннабиноидов и их взаимодействия с рецепторами CB1 и CB2 в компенсаторных и восстановительных механизмах мозга после повреждения. Исследования на животных показали, что введение экзогенного КБД после черепно-мозговой травмы уменьшает краткосрочные повреждения головного мозга за счёт улучшения метаболической активности мозга, снижения нарушений церебральной гемодинамики, уменьшения отёка мозга и судорог. Считается, что эти преимущества обусловлены способностью КБД повышать уровень анандамида.[109]
Лечение с помощью CBD
Лечение КБР также может уменьшить интенсивность и воздействие симптомов, обычно связанных с ПТСР, включая хроническую тревогу в стрессовой обстановке.[11] Воздействие стресса может вызвать тревогу у пациентов с ПТСР и напомнить им о травматических переживаниях. В исследованиях на людях испытуемые, оказавшиеся в условиях страха, демонстрировали снижение посттестовой тревожности при лечении КБР.[5] Клинический случай человека продемонстрировал, что терапия смолой каннабиса, содержащей CBD, помогла вызвать значительное уменьшение симптомов тревоги и депрессии у пациента-подростка, страдающего ПТСР.[96] Уменьшая вызванную тревогу, CBD может помочь регулировать негативные эффекты, связанные с ПТСР. На моделях на грызунах КБР эффективно блокировал формирование воспоминаний о страхе.[112,113] КБР может быть эффективной стратегией борьбы с приобретением памяти о страхе при ПТСР из-за его прямого воздействия, уменьшающего тяжесть травматической памяти. Исследования на крысах также показали, что КБД может ослаблять память о страхе, о чём свидетельствует значительное сокращение времени, в течение которого животные замирают при повторном воздействии ситуации, вызывающей тревогу.[91] В ходе экспериментов на мышах было также доказано, что лечение КБД ослабляет контекстуальные воспоминания, связанные с прошлым опытом, что свидетельствует о способности КБД разрушать негативные воспоминания.[1]
Антидепрессивные и нейропротекторные свойства
Антидепрессанты, используемые для лечения депрессии и некоторых тревожных расстройств, также обладают многочисленными нейропротекторными свойствами, такими как предотвращение образования амилоидных бляшек, повышение уровня BDNF, снижение активации микроглии и снижение уровня провоспалительных медиаторов.[82] Аналогичным образом, CBD снижает выработку воспалительных цитокинов, активацию клеток микроглии и инфильтрацию лейкоцитов головного мозга.[79]
Крысиные модели: эффективность КБД при нейроповеденческих расстройствах
На крысиных моделях нейроповеденческих расстройств КБД продемонстрировал ослабление острых вегетативных реакций, вызванных стрессом, а также анксиолитический и антидепрессивный эффекты за счёт активации рецепторов 5HT1A, подобно фармацевтическому препарату буспирону, который одобрен для лечения тревожности и депрессии у людей. [114] КБД экспериментально ослабляет снижение нейрогенеза в гиппокампе и плотности дендритных шипиков, вызванное хроническим стрессом, и предотвращает активацию микроглии в фармакологической модели шизофрении. Двойное слепое рандомизированное клиническое исследование КБД показало значительное клиническое улучшение, аналогичное действию антипсихотического препарата амисульприда, но с меньшим количеством побочных эффектов.[69] Сообщалось о модуляции аутофагии и повышении выживаемости нейронов при использовании КБД в экспериментальных моделях нейродегенеративных заболеваний, что указывает на пользу КБД при лечении психических/когнитивных симптомов, связанных с нейродегенерацией.[10]
Исследования с использованием МРТ у людей, связанные с КБД
Исследования с использованием методов нейровизуализации на людях показали, что КБД влияет на области мозга, участвующие в нейробиологии психических расстройств. Исследование показало, что однократная пероральная доза КБД у здоровых добровольцев изменяет активность в состоянии покоя в лимбических и паралимбических областях мозга, а также снижает субъективную тревожность, связанную с процедурой сканирования. [24,39] КБД снижал активность левого комплекса миндалевидного тела и гиппокампа, гипоталамуса и задней поясной коры, а также повышал активность левой парагиппокампальной извилины по сравнению с плацебо. У здоровых добровольцев, принимавших КБД и наблюдавших за выражением страха на лицах, наблюдалось снижение активности миндалевидного тела, передней и задней поясной коры, а также нарушение связи между миндалевидным телом и передней поясной корой. У здоровых людей КБД устранял анксиогенные эффекты Δ9-ТГК и снижал тревожность при выполнении задания, имитирующего публичное выступление. [5,24,39]
Тетрагидроканнабинол
Интересно, что ТГК, вводимый до получения травмы в исследованиях на людях и животных, оказывал измеримое нейропротекторное действие. В трёхлетнем ретроспективном исследовании пациентов, перенёсших черепно-мозговую травму (ЧМТ), сообщалось о снижении смертности у лиц с положительным результатом теста на Δ9-ТГК. На мышиных моделях повреждений ЦНС предварительное введение Δ9-ТГК обеспечивало защиту от нарушений.[105]
Облегчение тревоги у людей
Что касается снижения тревожности у людей, то реакция на каннабис зависит от множества факторов, таких как относительная концентрация Δ9-ТГК и других фитоканнабиноидов. Исследования показали, что Δ9-ТГК способствует угасанию страха. [2,45] 9-ТГК нарушает реконсолидацию памяти о страхе, что зависит от активации рецептора CB1. [19] У людей пероральный приём дронабинола (синтетического 9-ТГК) предотвращает восстановление страха. В целом фитоканнабиноиды положительно влияют на состояния, связанные с хроническим стрессом. Исследования на крысах показали, что каннабиноиды предотвращают негативное влияние острого стресса на обучение и память, а также улучшают нейропластичность, поведенческие и нейроэндокринные показатели тревожности и депрессии. [1,8,17,91,96,107,112,123,128]
Рак
КБР и ТГК
Рак — это заболевание, характеризующееся неконтролируемым делением клеток и их способностью к распространению. Новые противораковые препараты часто тестируют на предмет их способности вызывать апоптоз и поддерживать стабильную популяцию клеток. В начале 1970-х годов было доказано, что фитоканнабиноиды подавляют рост опухолей и продлевают жизнь мышей с аденокарциномой лёгких. Более поздние исследования показали, что каннабиноиды ингибируют рост опухолевых клеток и индуцируют апоптоз, модулируя различные клеточные сигнальные пути в глиомах, лимфомах, раковых клетках предстательной железы, молочной железы, кожи и поджелудочной железы.[26,76]
Применение при мультиформной глиобластоме
Мультиформная глиобластома (МГБ) — наиболее распространённый вид злокачественных первичных опухолей головного мозга. Исследования на животных и людях показали, что как Δ9-ТГК, так и КБД, по отдельности и в сочетании, оказывают значительное противоопухолевое действие на раковые клетки МГБ. Механизм противоопухолевого действия Δ9-ТГК заключается в передаче сигналов, связанных со стрессом эндоплазматического ретикулума, и повышении уровня коактиваторов транскрипции, которые способствуют аутофагии. [13,14,101,102]
КБД замедляет рост различных опухолевых ксенотрансплантатов
Также было доказано, что КБД замедляет рост различных типов опухолевых ксенотрансплантатов, включая глиомы. Считается, что механизм действия КБД заключается в усилении выработки активных форм кислорода в клетках глиомы, что приводит к цитотоксичности, апоптозу и аутофагии. [71,74,75,76] КБД способен подавлять инвазию и метастазирование раковых клеток за счёт ингибирования эпидермального фактора роста, путей NF-κB и mTOR. Сигнальный путь mTOR выступает в качестве центрального регулятора клеточного метаболизма, роста, пролиферации и выживаемости клеток и имеет решающее значение для подавления роста опухоли. КБД также снижает ангиогенез, воздействуя как на опухолевые, так и на эндотелиальные клетки. [111] В настоящее время в исследованиях на людях изучается терапевтический эффект совместного применения ТГК и КБД. [26,71,110,111]
В феврале 2017 года компания GW Pharmaceuticals объявила о положительных результатах второй фазы плацебо-контролируемого клинического исследования их запатентованного препарата, сочетающего в себе Δ9-ТГК и КБД, на 21 пациенте с рецидивирующей глиобластомой. Результаты показали, что годовая выживаемость в группе, получавшей лечение, составила 83 % по сравнению с 53 % в группе, получавшей плацебо (P = 0,042). Медиана выживаемости составила более 550 дней по сравнению с 369 днями в группе, получавшей плацебо. Впоследствии компания GW Pharmaceuticals получила от Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) и Европейского агентства лекарственных средств (EMA) статус орфанного препарата для комбинации Δ9-ТГК и КБД при лечении злокачественной глиомы.[47]
Трудноизлечимая эпилепсия
Каннабидиол
Сообщения об использовании каннабиса для лечения эпилепсии появились ещё в 1800 году до нашей эры. В 1881 году появились научные отчёты неврологов, которые с большим успехом использовали индийскую коноплю для лечения эпилепсии. [104] Применение каннабиса для лечения эпилепсии сократилось с появлением фенобарбитала и фенитоина и принятием законов, запрещающих употребление марихуаны в США.
Эксперименты с Δ9-ТГК показали, что у мышей он вызывает гипервозбудимость центральной нервной системы, повышенную возбудимость нейронов и чувствительность к судорогам. Поэтому его не использовали в большинстве исследований трудноизлечимой эпилепсии. Однако КБД оказывает противоэпилептическое и противосудорожное действие как in vitro, так и in vivo [64,51,61,62,63,85]
Совсем недавно, в 1980 году, Кунья и др. опубликовали результаты двойного слепого исследования, в котором оценивалась эффективность КБД при лечении трудноизлечимой эпилепсии у 16 пациентов с генерализованными судорожными припадками. Каждый пациент получал 200–300 мг КБД или плацебо в день вместе с противоэпилептическими препаратами в течение 4 месяцев.[25] В группе, получавшей лечение, у 7 из 8 пациентов наблюдалось уменьшение количества припадков. В группе, получавшей плацебо, у 1 из 8 пациентов наблюдалось уменьшение количества припадков.[25,124,129] С момента публикации этого отчёта возобновился интерес к использованию медицинской марихуаны в клинических целях, но большинство исследований представляют собой отдельные случаи из практики и небольшие клинические испытания. Все они свидетельствуют о том, что КБД, непсихоактивное соединение в составе каннабиса, потенциально может быть полезен для контроля припадков, не поддающихся медикаментозному лечению.
Как и в случае с большинством исследований каннабиноидов на сегодняшний день, проведение исследований может быть затруднено из-за ограниченного легального доступа к медицинской марихуане и экстрактам фитоканнабиноидов. Однако КБД, получаемый из конопли, в последнее время стал менее регулируемым, и в результате возрос интерес к исследованиям КБД при рефрактерной эпилепсии.
КБД снижают гиперактивность нейронов при эпилепсии
Общий эффект КБД, по-видимому, заключается в снижении гиперактивности нейронов при эпилепсии. [20,56] Как уже говорилось ранее, рецептор CB1 — это пресинаптический рецептор, связанный с G-белком, который активирует потенциалзависимые кальциевые каналы и усиливает проводимость калиевых каналов в пресинаптических окончаниях. В то время как Δ9-THC напрямую связывается с рецепторами CB1, КБД оказывает косвенное воздействие, повышая выработку эндогенного анандамида. Анандамид влияет на возбудимость нейронных сетей, активируя катионные каналы транзиторного рецепторного потенциала (TRP). Регуляция гомеостаза Ca2+ с помощью КБД может способствовать проявлению этих эффектов, особенно при парциальных или генерализованных судорогах.[62]
Эндогенные каннабиноиды
Эндогенные каннабиноиды, по-видимому, влияют на возникновение, распространение и эпилептические припадки. Исследования выявили нарушения в эндоканнабиноидной системе у некоторых пациентов с рефрактерными эпилептическими расстройствами, в частности низкий уровень анандамида и уменьшенное количество рецепторов CB1 в спинномозговой жидкости и тканях, взятых при биопсии. [97] Кроме того, эндоканнабиноидная система сильно активируется при эпилептических припадках, а повышение активности рецепторов CB1 оказывает противосудорожное действие. [27]
Фармацевтическая компания GW Pharmaceuticals в настоящее время разрабатывает препарат CBD Epidiolex®, представляющий собой очищенный экстракт CBD на 99% масляной основе из растения каннабис. Результаты недавнего открытого исследования 2015 года (без плацебо-контроля) с участием 137 человек с резистентной к лечению эпилепсией показали, что приём препарата Эпидиолекс® в течение 12 недель снизил среднее количество приступов на 54 %. [29,30] Примечательно, что возраст участников исследования варьировался от 2 до 26 лет, а средний возраст составлял 11 лет. Дозировка КБД (Epidiolex®) составляла 2–5 мг/кг в день, титрование проводилось до появления непереносимости или до достижения максимальной дозы 25 мг/кг или 50 мг/кг в день (в зависимости от места проведения исследования). Хотя в этом исследовании изучалось исключительно влияние на частоту приступов, нет никаких доказательств того, что противосудорожное действие КБД ограничивается лечением этого заболевания. В США продолжаются другие открытые исследования препарата Эпидиолекс®. В настоящее время Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США выдало разрешение на «гуманитарное применение» этого препарата для ограниченного числа пациентов с резистентными к лечению эпилептическими синдромами, такими как синдром Леннокса — Гасто (резистентная к лечению эпилепсия детского возраста, характеризующаяся множественными типами припадков и задержкой развития) у детей и взрослых и синдром Драве (тяжелая миоклоническая эпилепсия младенчества) у детей. Также ведётся разработка синтетических форм КБД для лечения судорог и других расстройств, связанных с фитоканнабиноидом КБД.
Несмотря на доклинические данные компании GW Pharmaceutical и отдельные сообщения об эффективности каннабиса при лечении эпилепсии, в Кокрейновском обзоре 2014 года был сделан вывод о том, что «в настоящее время нельзя сделать достоверных выводов об эффективности каннабиноидов при лечении эпилепсии». В этом отчёте отмечалось, что такой вывод был сделан в основном из-за отсутствия достаточных данных рандомизированных контролируемых исследований Δ9-ТГК, КБД или любых других каннабиноидов в комбинации. [28,38,43,83]
Безопасность
Всесторонний обзор безопасности и побочных эффектов КБД, проведенный в 2016 году на основе исследований на животных и людях, показал, что КБД безопасен для человека в широком диапазоне доз. Наиболее распространенными побочными эффектами были усталость, диарея и изменения аппетита/веса.[57] В исследованиях, в которых сравнивались другие лекарственные препараты, используемые для лечения этих заболеваний, КБД также показал очень благоприятный профиль побочных эффектов. КБД взаимодействует с распространенными ферментами печени, участвующими в метаболизме (лекарственных) препаратов, которые относятся к семейству цитохромов P450. Таким образом, необходимо учитывать взаимодействие с переносчиками лекарственных средств и взаимодействие с лекарственными средствами.[6]
КБД безопаснее других каннабиноидов
CBD также имеет лучший профиль безопасности по сравнению с другими каннабиноидами, такими как ТГК. Например, высокие дозы CBD (до 1500 мг / сут) хорошо переносятся животными и людьми. В отличие от ТГК, CBD не изменяет частоту сердечных сокращений, кровяное давление или температуру тела, не вызывает каталепсии и не изменяет психомоторные или психологические функции.[92] Этот улучшенный профиль безопасности может быть результатом отсутствия у него свойств прямого агониста каннабиноидных рецепторов.[4]
Синтетический аналог набилона
Синтетический аналог Δ9-ТГК, набилон (Cesamet™; Valeant Pharmaceuticals North America), был одобрен в 1981 году для купирования тошноты и рвоты, вызванных химиотерапией. Синтетический Δ9-ТГК, дронабинол (Marinol®; Solvay Pharmaceuticals), был впоследствии лицензирован в 1985 году как противорвотное средство, а в 1992 году — как стимулятор аппетита. Способность Δ9-ТГК стимулировать рецептор CB1 парадоксальным образом является как основной причиной, так и препятствием для его терапевтического применения. На самом деле, как будет показано ниже, психотропные эффекты, а также потенциальный риск побочных эффектов со стороны сердечно-сосудистой системы, толерантность и зависимость ограничивают применение Δ9-ТГК в качестве синтетического или растительного компонента во многих терапевтических целях.[87]
Неблагоприятные последствия
В обзоре 34 статей о рассеянном склерозе, опубликованных Американской академией неврологии в 2014 году, отмечалось несколько побочных эффектов от применения каннабиноидов в различных формах. Сообщалось о таких симптомах, как тошнота, повышенная слабость, изменения в поведении или настроении (или и то, и другое), суицидальные мысли или галлюцинации, головокружение или вазовагальные симптомы (или и то, и другое), усталость и чувство опьянения. Психоз, дисфория и тревожность были связаны с более высокими концентрациями ТГК. Однако не было зафиксировано ни одного случая смерти от передозировки марихуаной, даже среди тех, кто употреблял её в рекреационных целях и использовал всё более сильнодействующие сорта. Возможно, это связано с отсутствием эндоканнабиноидных рецепторов в стволе головного мозга.[66]
В соответствии с недавним изменением правил Всемирным антидопинговым агентством или ВАДА, CBD больше не будет внесен в список запрещенных веществ для международных спортивных соревнований в 2018 году. Агентство отметило, что Δ9-ТГК по-прежнему будет запрещен. ВАДА опубликовало это постановление, в котором отмечается, что CBD, извлеченный из растений каннабиса, все еще может содержать различные концентрации ТГК.[119] CBD, извлеченный из растения конопли, по определению содержит <0,3% Δ9-THC.
Дозирование
В рамках данного обзора невозможно дать какие-либо значимые рекомендации по дозировке КБД или Δ9-ТГК. Как и другие каннабиноиды, КБД вызывает колоколообразные кривые зависимости «доза — реакция» и может действовать по-разному в зависимости от концентрации или одновременного присутствия других каннабиноидных лигандов. [11,70] В целом из-за значительных психоактивных свойств Δ9-ТГК диапазон терапевтических доз ограничен побочными эффектами. Учитывая, что в настоящее время на рынке представлено около 850 брендов продуктов с КБД, полученных из марихуаны, и 150 брендов продуктов, полученных из конопли, а также ещё большее количество различных экстрактов Δ9-ТГК и растений марихуаны, выращенных для получения максимальной концентрации Δ9-ТГК, универсальные рекомендации по дозировке практически невозможны.
Назначение медицинской марихуаны
В конечном счёте назначение медицинской марихуаны в качестве основного или вспомогательного лечения требует особой осторожности и знания целей и ожиданий пациента от лечения. В штатах, где разрешена медицинская марихуана, перед назначением обычно требуется пройти обучение и получить сертификат. Прежде чем рекомендовать марихуану пациенту, следует ответить на ряд общих вопросов. Как минимум, эти вопросы должны включать следующее:[118]
- Есть ли документальное подтверждение того, что пациенту не помогли другие традиционные методы лечения?
- Проконсультировали ли вы пациента (что подтверждается подписанным пациентом информированным согласием) о медицинских рисках, связанных с употреблением марихуаны, — медицинских, психологических и социальных (таких как ухудшение навыков вождения или работы) — и о привыкании?
- Есть ли у вашего пациента в анамнезе случаи злоупотребления марихуаной или другими психоактивными веществами, вызывающими привыкание, отпускаемыми по рецепту или запрещенными?
- Будете ли вы проходить периодические тесты на наркотики?
- Будете ли вы знать, насколько стандартизирована и эффективна медицинская марихуана, которую вы используете, и не содержит ли она примесей?
Утверждения FDA
Управление по САНИТАРНОМУ НАДЗОРУ ЗА КАЧЕСТВОМ ПИЩЕВЫХ ПРОДУКТОВ И МЕДИКАМЕНТОВ США одобрило синтетические препараты Цезамет®, Маринол® и Синдрос® для терапевтического применения в США. Опубликованные Управлением ПО САНИТАРНОМУ НАДЗОРУ За КАЧЕСТВОМ ПИЩЕВЫХ ПРОДУКТОВ и МЕДИКАМЕНТОВ США показания включают тошноту и лечение анорексии, связанной с потерей веса у пациентов со СПИДом. Маринол® и Синдрос® содержат активный ингредиент дронабинол, синтетический дельта-9-ТГК. Цезамет® содержит активный ингредиент набилон, который по химической структуре аналогичен ТГК и также получен синтетическим путем. Хотя эти препараты часто упоминаются в клинических исследованиях с участием людей, их применение в целом ограничено как побочными эффектами, так и противопоказаниями.
ЗАКЛЮЧЕНИЕ
Несмотря на то, что федеральные законы и законы штатов противоречат друг другу в отношении законности производства каннабиса, его полезные свойства для здоровья, которые подтверждаются всё большим количеством исследований, вновь делают его актуальным в медицине. Современные исследования показывают, что фитоканнабиноиды обладают мощным терапевтическим потенциалом при лечении различных заболеваний, в первую очередь благодаря их взаимодействию с эндоканнабиноидной системой. КБД представляет особый интерес благодаря широкому спектру его возможностей и отсутствию побочных эффектов при лечении различных неврологических состояний и заболеваний.
Легализация марихуаны во многих штатах: необходимость просвещения
Из-за быстрой легализации медицинской марихуаны большинством законодательных органов штатов США врачи сталкиваются с нехваткой формального образования и базовых знаний о возможных показаниях, побочных эффектах, взаимодействии с другими препаратами и дозировке при назначении медицинской марихуаны. Из-за федеральных ограничений на исследования с участием людей в США нам не хватает количества и качества испытаний на людях, которые обычно проводятся при назначении лекарств. Этот обзор, посвящённый неврологическому эффекту фитоканнабиноидов, продемонстрировал их значительную пользу для нейропротекции и снижения риска развития широкого спектра неврологических заболеваний и состояний у людей.
Финансовая поддержка и спонсорство
Ноль.
Конфликты интересов
Авторы заявляют о следующих конфликтах интересов: Медицинский центр Университета Питтсбурга — работодатель, Национальная футбольная лига — медицинский консультант — неоплачиваемый консультант, Футбольный клуб «Питтсбург Стилерз» — медицинский консультант — неоплачиваемый консультант, World Wrestling Entertainment Corporation — оплачиваемый консультант, ImPACT Applications, INC (неотложная оценка состояния после сотрясения мозга и когнитивное тестирование) — акционер, член совета директоров, CV Sciences — акционер.
Подтверждение
Деннис и Роуз Хайндл, Нельсон и Клаудия Пельц, фонды Mylan Labs, Льюис Топпер, Ширли Мандел, Джон и Кэти Гарсия и фонд Neuroscience Research.
Примечания
Информация об участнике
Джозеф Марун, электронная почта: maroonjc@upmc.edu.
Джефф Бост, электронная почта: Bostj@upmc.edu.
ССЫЛКИ
- Абуш Х., Акирав И. Каннабиноиды улучшают состояние синаптической пластичности и кратковременной памяти при хроническом стрессе. Нейропсихофармакология. 2013;38:1521–34. doi: 10.1038/npp.2013.51.1. [DOI] [Бесплатная статья в журнале PMC] [PubMed] [Google Scholar]
- Асо Э., Джувес С., Мальдонадо Р., Феррер И. Агонист каннабиноидных рецепторов CB2 улучшает состояние мышей с фенотипом, подобным болезни Альцгеймера, A beta PP/PS1. J Alzheimers Dis. 2013;35:847–58. doi: 10.3233/JAD-130137.2. [DOI] [PubMed] [Google Scholar]
- Бейкер Д., Прайс Г., Крокфорд Дж. Л., Браун П., Пертви Р. Г., Хаффман Дж. У. и др. Каннабиноиды контролируют спастичность и тремор в модели рассеянного склероза. Nature. 2000;404:84–7. doi: 10.1038/35003583.3. [DOI] [PubMed] [Google Scholar]
- Бергамаски М. М., Кейруш Р. Х., Зуарди А. У., Криппа А. Дж. Безопасность и побочные эффекты каннабидиола: компонента Cannabis sativa. Curr Drug Saf. 2011;6:237–49. doi: 10.2174/157488611798280924.4. [DOI] [PubMed] [Google Scholar]
- Бергамаски М. М., Кейруш Р. Х. С., Шагас М. Х. Н., де Оливейра Д. К. Г., де Мартини Б. С., Капчински Ф. и др. Каннабидиол снижает тревожность, вызванную имитацией публичных выступлений, у пациентов с социальной фобией, ранее не получавших лечения. Нейропсихофармакология. 2011;36:1219–26. doi: 10.1038/npp.2011.6.5. [DOI] [Бесплатная статья в журнале PMC] [PubMed] [Google Scholar]
- Би Ч. И., Чен Т., Нанн А. В., Базелот М., Даллас М., Уолли Б. Дж. Молекулярные мишени каннабидиола при неврологических расстройствах. Нейротерапия. 2015;12:699–730. doi: 10.1007/s13311-015-0377-3.6. [DOI] [Бесплатная статья в журнале PMC] [PubMed] [Google Scholar]
- Бореа П.А., Гесси С., Мериги С., Винченци Ф., Варани К. Патологическая гиперпродукция: обратная сторона аденозина. Br J Pharmacol. 2017;174:1945–60. doi: 10.1111/bph.13763.7. [DOI] [Бесплатная статья в журнале PMC] [PubMed] [Google Scholar]
- Бредт Д.С., Фьюри М.Л., Чен Г., Ловенберг Т., Древетс У.С., Манджи Х.К. Трансляция биомаркеров депрессии для улучшения таргетной терапии. Neurosci Biobehav Rev. 2015;59:1–15. doi: 10.1016/j.neubiorev.2015.09.013.8. [DOI] [PubMed] [Google Scholar]
- Браун А. Дж. Новые каннабиноидные рецепторы. Br J Pharmacol. 2007;152:567–75. doi: 10.1038/sj.bjp.0707481.9. [DOI] [Бесплатная статья в PMC] [PubMed] [Google Scholar]
- Кампус А.К., Фогаса М.В., Скаранте Ф.Ф., Жока С.Р.Л., Салес А.Ж., Гомеш Ф.В. и др. Пластические и нейропротекторные механизмы, участвующие в терапевтическом действии каннабидиола при психических расстройствах. Front Pharmacol. 2017;8:269. doi: 10.3389/fphar.2017.00269.10. [DOI] [Бесплатная статья в журнале PMC] [PubMed] [Google Scholar]
- Кампус А.К., Морейра Ф.А., Гомеш Ф.В., Дель Бел Э.А., Гимарайнш Ф.С. Многочисленные механизмы, лежащие в основе терапевтического потенциала каннабидиола при лечении психических расстройств. Philos Trans R Soc Lond B Biol Sci. 2012;367:3364–78. doi: 10.1098/rstb.2011.0389.11. [DOI] [Бесплатная статья в журнале PMC] [PubMed] [Google Scholar]
- Кампоса А.С., Фогач М.В., Сонегоа А.Б., Гимарайнша Ф.С. Каннабидиол, нейропротекция и нервно-психические расстройства. Pharmacol Res. 2016;112:119–27. doi: 10.1016/j.phrs.2016.01.033.12. [DOI] [PubMed] [Google Scholar]
- Карраседо А., Хиронелла М., Лоренте М., Гарсия С., Гусман М., Веласко Г. и др. Каннабиноиды вызывают апоптоз опухолевых клеток поджелудочной железы через гены, связанные со стрессом эндоплазматического ретикулума. Cancer Res. 2006;66:6748–55. doi: 10.1158/0008-5472.CAN-06-0169.13. [DOI] [PubMed] [Google Scholar]
- Карраседо А., Лоренте М., Эгиа А., Бласкес С., Гарсия С., Жиру В. и др. Белок p8, регулируемый стрессом, опосредует вызванный каннабиноидами птоз опухолевых клеток. Cancer Cell. 2006;9:301–12. doi: 10.1016/j.ccr.2006.03.005.14. [DOI] [PubMed] [Google Scholar]
- Кассан К., Либлау Р. С. Иммунная толерантность и контроль аутоиммунных заболеваний ЦНС: от моделей на животных к пациентам с рассеянным склерозом. J Neurochem. 2007;100:883–92. doi: 10.1111/j.1471-4159.2006.04270.x.15. [DOI] [PubMed] [Google Scholar]
- Кастильо А., Толона М. Р., Фернандес-Руисб, Х., Ромероа Х., Мартинес-Оргадоа Х. Нейропротекторный эффект каннабидиола в модели гипоксически-ишемического повреждения головного мозга новорожденных мышей in vitro опосредован рецепторами CB2 и аденозиновыми рецепторами. Neurobiol Dis. 2010;37:434–40. doi: 10.1016/j.nbd.2009.10.023.16. [DOI] [PubMed] [Google Scholar]
- Кастрен Э. Пластичность нейронных сетей и восстановление после депрессии. JAMA Psychiatry. 2013;70:983–9. doi: 10.1001/jamapsychiatry.2013.1.17. [DOI] [PubMed] [Google Scholar]
- Чентонце Д., Бари М., Росси С., Просперетти К., Фурлан Р., Фецца Ф. и др. Эндоканнабиноидная система нарушена при рассеянном склерозе и экспериментальном аутоиммунном энцефаломиелите. Журнал «Мозг». 2007;130(Pt 10):2543–53. doi: 10.1093/brain/awm160.18. [DOI] [PubMed] [Google Scholar]
- Чэнь Ж., Чжан Дж., Фань Н., Тэн Ц. З., У Ю., Ян Х. В. и др. Нарушения синаптической передачи и памяти, вызванные дельта(9)-ТГК, опосредованы передачей сигналов через ЦОГ-2. Cell. 2013;155:1154–65. doi: 10.1016/j.cell.2013.10.042.19. [DOI] [Бесплатная статья в журнале PMC] [PubMed] [Google Scholar]
- Консру П., Бенедито М. А., Лейте Дж. Р., Карлини Э. А., Мешулам Р. Влияние каннабидиола на поведенческие судороги, вызванные конвульсивными препаратами или электрическим током, у мышей. Eur J Pharmacol. 1982;83:293–8. doi: 10.1016/0014-2999(82)90264-3.20. [DOI] [PubMed] [Google Scholar]
- Консру П., Лагуна Дж., Аллендер Дж., Снайдер С., Стерн Л., Сэндик Р. и др. Контролируемое клиническое исследование каннабидиола при болезни Гентингтона. Pharmacol Biochem Behav. 1991;40:701–8. doi: 10.1016/0091-3057(91)90386-g.21. [DOI] [PubMed] [Google Scholar]
- Консру П., Масти Р., Рейн Дж., Тиллери У., Пертви Р. Восприятие эффекта от курения каннабиса пациентами с рассеянным склерозом. Eur Neurol. 1997;38:44–8. doi: 10.1159/000112901.22. [DOI] [PubMed] [Google Scholar]
- Консру П., Сэндик Р., Снайдер С. Р. Оценка эффективности каннабидиола при дистонических двигательных расстройствах. Int J Neurosci. 1986;30:277–82. doi: 10.3109/00207458608985678.23. [DOI] [PubMed] [Google Scholar]
- Криппа Дж. А., Зуарди А. У., Гарридо Дж. Э., Вихерт-Ана Л., Гуарньери Р., Феррари Л. и др. Влияние каннабидиола (КБД) на региональный мозговой кровоток. Нейропсихофармакология. 2004;29:417–26. doi: 10.1038/sj.npp.1300340.24. [DOI] [PubMed] [Google Scholar]
- Cunha JM, Carlini EA, Pereira AE, Ramos OL, Pimentel G, Gagliardi, et al. Хроническое введение каннабидиола здоровым добровольцам и пациентам с эпилепсией. Фармакология. 1980;21:175–85. doi: 10.1159/000137430.25. [DOI] [PubMed] [Google Scholar]
- Де Петрочеллис Л., Лигрести А., Скьяно Мориэлло А., Яппелли М., Верде Р., Стотт К. Г. и др. Каннабиноиды, не содержащие ТГК, подавляют рост карциномы предстательной железы in vitro и in vivo: проапоптотические эффекты и лежащие в их основе механизмы. Br J Pharmacol. 2013;168:79–102. doi: 10.1111/j.1476-5381.2012.02027.x.26. [DOI] [Бесплатная статья в PMC] [PubMed] [Google Scholar]
- Дешпанде Л.С., Блэр Р.Э., Зиобро Дж.М., Сомбати С., Мартин Б.Р., ДеЛоренцо Р.Дж. Эндоканнабиноиды блокируют эпилептический статус в культивируемых нейронах гиппокампа. Eur J Pharmacol. 2007;558:52–9. doi: 10.1016/j.ejphar.2006.11.030.27. [DOI] [Бесплатная статья в журнале PMC] [PubMed] [Google Scholar]
- Девински О., Силио М. Р., Кросс Х., Фернандес-Руис Х., Френч Дж., Хилл С. и др. Каннабидиол: фармакология и потенциальная терапевтическая роль при эпилепсии и других нервно-психических расстройствах. Эпилепсия. 2014;55:791–802. doi: 10.1111/epi.12631.28. [DOI] [Бесплатная статья в журнале PMC] [PubMed] [Google Scholar]
- Девински О., Марш Э., Фридман Д., Тиле Э., Ло Л., Салливан Дж. и др. Каннабидиол у пациентов с резистентной к лечению эпилепсией: открытое интервенционное исследование. Lancet Neurol. 2016;15:270–8. doi: 10.1016/S1474-4422(15)00379-8.29. [DOI] [PubMed] [Google Scholar]
- Девински О., Кросс Дж. Х., Локс Л., Марш Э., Миллер И., Наббат Р. и др. Исследование применения каннабидиола при лекарственно-устойчивых судорогах у пациентов с синдромом Драве. N Engl J Med. 2017;376:2011–20. doi: 10.1056/NEJMoa1611618.30. [DOI] [PubMed] [Google Scholar]
- Эспозито Дж., Де Филиппис Д., Стеардо Л., Скудери К., Савани К., Куомо В. и др. Селективная активация рецептора CB1 подавляет экспрессию белка iNOS, вызванную бета-амилоидом, в клетках C6 и впоследствии снижает гиперфосфорилирование тау-белка в совместно культивируемых нейронах. Neurosci Lett. 2006;404:342–6. doi: 10.1016/j.neulet.2006.06.012.31. [DOI] [PubMed] [Google Scholar]
- Эспозито Дж., Скудери К., Савани К., Стеардо Л., мл., Де Филиппис Д., Коттоне П. и др. Каннабидиол in vivo ослабляет вызванное бета-амилоидом нейровоспаление, подавляя экспрессию IL-1ß и iNOS. Br J Pharmacol. 2007;151:1272–9. doi: 10.1038/sj.bjp.0707337.32. [DOI] [Бесплатная статья в PMC] [PubMed] [Google Scholar]
- Эспозито Дж., Скудери К., Валенца М., Тогна Дж. И., Латина В. и др. Каннабидиол уменьшает вызванное абстиненцией нейровоспаление и способствует нейрогенезу в гиппокампе за счет участия PPARc. PLoS One. 2011;6:e28668. doi: 10.1371/journal.pone.0028668.33. [DOI] [Бесплатная статья в PMC] [PubMed] [Google Scholar]
- Феллермайер М., Айзенрайх В., Бахер А., Зенк М. Х. Биосинтез каннабиноидов. Eur J Biochem. 2001;268:1596–604. doi: 10.1046/j.1432-1033.2001.02030.x.34. [DOI] [PubMed] [Google Scholar]
- Фернандес-Руис Х., Морено-Мартет М., Родригес-Куэто С., Паломо-Гаро С., Гомес-Канас М., Вальдеоливас С. и др. Перспективы применения каннабиноидов при заболеваниях базальных ганглиев. Br J Pharmacol. 2011;163:1365–78. doi: 10.1111/j.1476-5381.2011.01365.x.35. [DOI] [Бесплатная статья в журнале PMC] [PubMed] [Google Scholar]
- Фримен Р. М., Адеканми О., Уотерфилд М. Р., Уотерфилд А. Э., Райт Д., Зайчек Дж. Влияние каннабиса на ургентное недержание мочи у пациентов с рассеянным склерозом: многоцентровое рандомизированное плацебо-контролируемое исследование (CAMS-LUTS) Int Urogynecol J Pelvic Floor Dysfunct. 2006;17:636–41. doi: 10.1007/s00192-006-0086-x.36. [DOI] [PubMed] [Google Scholar]
- Фройнд Т. Ф., Катона И., Пиомелли Д. Роль эндогенных каннабиноидов в синаптической передаче сигналов. Physiol Rev. 2003;83:1017–66. doi: 10.1152/physrev.00004.2003.37. [DOI] [PubMed] [Google Scholar]
- Фридман Д., Девински О. Каннабиноиды в лечении эпилепсии. N Engl J Med. 2015;373:1048–58. doi: 10.1056/NEJMra1407304.38. [DOI] [PubMed] [Google Scholar]
- Fusar-Poli P, Crippa JA, Bhattacharyya S, Borgwardt SJ, Allen P, Martin-Santos R, et al. Различное влияние Δ9-тетрагидроканнабинола и каннабидиола на нейронную активацию во время обработки эмоций. Архив общей психиатрии. 2009;66:95–105. doi: 10.1001/archgenpsychiatry.2008.519.39. [DOI] [PubMed] [Google Scholar]
- Гаони И., Мешулам Р. Выделение структуры и частичный синтез активного компонента гашиша. J Am Chem Soc. 1964;86:1646–7.40. [Google Scholar]
- Гарсия-Аренсибиа М., Гонсалес С., де Лаго Э., Рамос Х. А., Мешулам Р., Фернандес-Руис Х. Оценка нейропротекторного эффекта каннабиноидов на крысиной модели болезни Паркинсона: важность антиоксидантных свойств и независимости от каннабиноидных рецепторов. Brain Res. 2007;1134:162–70. doi: 10.1016/j.brainres.2006.11.063.41. [DOI] [PubMed] [Google Scholar]
- Гласс М., Драгунов М., Фолл Р. Л. Каннабиноидные рецепторы в головном мозге человека: подробное анатомическое и количественное авторадиографическое исследование головного мозга плода, новорожденного и взрослого человека. Нейронаука. 1997;77:299–318. doi: 10.1016/s0306-4522(96)00428-9.42. [DOI] [PubMed] [Google Scholar]
- Глосс Д., Викри Б. Каннабиноиды при эпилепсии. Кокрейновская база данных систематических обзоров. 2014;3:CD009270. doi: 10.1002/14651858.CD009270.pub3.43. [DOI] [Бесплатная статья в PMC] [PubMed] [Google Scholar]
- Гоуран А., Нунан Дж., Кэмпбелл В. А. Многообразие действия каннабиноидов: значение для лечения нейродегенеративных заболеваний. CNS Neurosci Ther. 2011;17:637–44. doi: 10.1111/j.1755-5949.2010.00195.x.44. [DOI] [Бесплатная статья в PMC] [PubMed] [Google Scholar]
- Гринспун Л., Бакалар Дж. Б. Использование каннабиса в качестве стабилизатора настроения при биполярном расстройстве: неофициальные данные и необходимость клинических исследований. Журнал «Психоактивные вещества». 1998;30:171–7. doi: 10.1080/02791072.1998.10399687.45. [DOI] [PubMed] [Google Scholar]
- Го Дж., Икеда С. Р. Эндоканнабиноиды модулируют кальциевые каналы N-типа и сопряженные с G-белком калиевые каналы внутреннего выпрямления через каннабиноидные рецепторы CB1, гетерологично экспрессированные в нейронах млекопитающих. Mol Pharmacol. 2004;65:665–74. doi: 10.1124/mol.65.3.665.46. [DOI] [PubMed] [Google Scholar]
- 47.Gwpharm.com. Компания GW Pharmaceuticals добилась положительных результатов во второй фазе исследования концепции лечения глиомы. [Последнее посещение 29 января 2018 г.]. Доступно по ссылке: https://www.gwpharm.com/about-us/news/gw-pharmaceuticals-achieves-positive-results-phase-2-proof-concept-study-glioma/
- Хэмпсон А. Дж., Гримальди М., Аксельрод Дж., Винк Д. Каннабидиол и (-)Δ9-тетрагидроканнабинол являются нейропротекторными антиоксидантами. Proc Natl Acad Sci USA. 1998;95:8268–73. doi: 10.1073/pnas.95.14.8268.48. [DOI] [Бесплатная статья в журнале PMC] [PubMed] [Google Scholar]
- Хануш Л. О., Мейер С. М., Муньос Э., Тальялатела-Скафати О., Аппендино Г. Фитоканнабиноиды: единый критический обзор. Nat Prod Rep. 2016;33:1357. doi: 10.1039/c6np00074f.49. [DOI] [PubMed] [Google Scholar]
- Германн Д., Шнайдер М. Потенциальное защитное действие каннабидиола при нейроанатомических изменениях у потребителей каннабиса и при психозах: критический обзор. Curr Pharm Des. 2012;18:4897–905. doi: 10.2174/138161212802884825.50. [DOI] [PubMed] [Google Scholar]
- Хилл А. Дж., Уильямс К. М., Уолли Б. Дж., Стивенс Г. Дж. Фитоканнабиноиды как новые терапевтические средства при заболеваниях ЦНС. Pharmacol Ther. 2012;133:79–97. doi: 10.1016/j.pharmthera.2011.09.002.51. [DOI] [PubMed] [Google Scholar]
- Хилл К. П. Медицинская марихуана для лечения хронической боли и других медицинских и психиатрических проблем: клинический обзор. JAMA. 2015;313:2474–83. doi: 10.1001/jama.2015.6199.52. [DOI] [PubMed] [Google Scholar]
- Хиллард С. Дж. Эндоканнабиноиды и функция сосудов. J Pharmacol Exp Ther. 2000;294:27–32.53. [PubMed] [Google Scholar]
- Хоулетт А.С., Барт Ф., Боннер Т.И., Кабрал Г., Каселлас П., Дивейн У.А. и др. Международный союз фармакологии. XXVII. Классификация каннабиноидных рецепторов. Pharmacol Rev. 2002;54:161–202. doi: 10.1124/pr.54.2.161.54. [DOI] [PubMed] [Google Scholar]
- Хантли А. Обзор доказательств эффективности комплементарной и альтернативной медицины при рассеянном склерозе. Int MS J. 2006;13:5–12.55. [PubMed] [Google Scholar]
- Яннотти Ф.А., Хилл К.Л., Лео А., Альхусаини А., Субран К., Маццарелла Э. и др. Непсихотропные растительные каннабиноиды, канбидиварин (CBDV) и каннабидиол (CBD), активируют и снижают чувствительность каналов transient receptor potential vanilloid 1 (TRPV1) in vitro: потенциал для лечения гипервозбудимости нейронов. ACS Chem Neurosci. 2014;5:1131–41. doi: 10.1021/cn5000524.56. [DOI] [PubMed] [Google Scholar]
- Иффланд К., Гротенхермен Ф. Германия: Хюрт; 2016. Октябрь, обзор Европейской ассоциации промышленной конопли (EIHA): безопасность и побочные эффекты каннабидиола — обзор клинических данных и соответствующих исследований на животных.57. [DOI] [Бесплатная статья в PMC] [PubMed] [Google Scholar]
- Искеджян М., Береза Б., Гордон А., Пивко К., Эйнарсон Т. Р. Метаанализ методов лечения нейропатической боли и боли, связанной с рассеянным склерозом, с использованием каннабиса. Curr Med Res Opin. 2007;23:17–24. doi: 10.1185/030079906×158066.58. [DOI] [PubMed] [Google Scholar]
- Ювоне Т., Эспозито Дж., Эспозито Р., Сантамария Р., Ди Роза М., Иззо А. А. Нейропротекторное действие каннабидиола, непсихоактивного компонента Cannabis sativa, на токсичность, вызванную бета-амилоидом, в клетках PC12. J Neurochem. 2004;89:134–41. doi: 10.1111/j.1471-4159.2003.02327.x.59. [DOI] [PubMed] [Google Scholar]
- Ювоне Т., Эспозито Дж., Де Филиппис Д., Скудери К., Стеардо Л. Каннабидиол: перспективный препарат для лечения нейродегенеративных заболеваний? CNS Neurosci Ther. 2009;15:65–75. doi: 10.1111/j.1755-5949.2008.00065.x.60. [DOI] [Бесплатная статья в журнале PMC] [PubMed] [Google Scholar]
- Джонс Н.А., Глин С.Э., Акияма С., Хилл Т.Д.М., Хилл А.Дж., Уэстон С.Э. и др. Каннабидиол оказывает противосудорожное действие на животных с височной эпилепсией и парциальными припадками. Seizure-Eur J Epilepsy. 2012;21:344–52. doi: 10.1016/j.seizure.2012.03.001.61. [DOI] [PubMed] [Google Scholar]
- Джонс Н.А., Хилл А.Дж., Смит И., Беван С.А., Уильямс К.М., Уолли Б.Дж. и др. Каннабидиол обладает противоэпилептическими и противосудорожными свойствами in vitro и in vivo. J Pharmacol Exp Ther. 2010;332:569–77. doi: 10.1124/jpet.109.159145.62. [DOI] [Бесплатная статья в журнале PMC] [PubMed] [Google Scholar]
- Капур А., Чжао П. В., Шаир Х., Бай Ю. С., Кэрон М. Г., Барак Л. С. и др. Типичная реакция рецептора GPR55 на каннабиноидные лиганды. J Biol Chem. 2009;284:29817–27. doi: 10.1074/jbc.M109.050187.63. [DOI] [Бесплатная статья в PMC] [PubMed] [Google Scholar]
- Карлер Р., Колдер Л. Д., Турканис С. А. Длительная повышенная возбудимость ЦНС у мышей после однократного воздействия дельта-9-тетрагидроканнабинола. Нейрофармакология. 1989;25:441–6. doi: 10.1016/0028-3908(86)90240-6.64. [DOI] [PubMed] [Google Scholar]
- Ким Д., Тайер С. А. Каннабиноиды препятствуют образованию новых синапсов между нейронами гиппокампа в культуре. J Neurosci. 2001;21:RC146. doi: 10.1523/JNEUROSCI.21-10-j0004.2001.65. [DOI] [Бесплатная статья в журнале PMC] [PubMed] [Google Scholar]
- Коппел Б.С., Браст Дж.К.М., Файф Т., Бронштейн Дж., Юссоф С., Гронсет Г. и др. Систематический обзор: эффективность и безопасность медицинской марихуаны при некоторых неврологических расстройствах. Отчет подкомитета по разработке рекомендаций Американской академии неврологии. Неврология. 2014;82:1556–63. doi: 10.1212/WNL.0000000000000363.66. [DOI] [Бесплатная статья в журнале PMC] [PubMed] [Google Scholar]
- Крейцер А.С., Маленка Р.С. Дофаминовая модуляция зависимого от состояния высвобождения эндоканнабиноидов и долговременной депрессии в полосатом теле. Журнал нейрофизиологии. 2005;25:10537–45. doi: 10.1523/JNEUROSCI.2959-05.2005.67. [DOI] [Бесплатная статья в журнале PMC] [PubMed] [Google Scholar]
- Лафуркад М., Элезгарай И., Мато С., Бакири Ю., Грандес П., Манзони О. Дж. Молекулярные компоненты и функции эндоканнабиноидной системы в префронтальной коре головного мозга мышей. PLoS One. 2007;2:e709. doi: 10.1371/journal.pone.0000709.68. [DOI] [Бесплатная статья в журнале PMC] [PubMed] [Google Scholar]
- Leweke FM, Piomelli D, Pahlisch F, Muhl D, Gerth CW, Hoyer C, et al. Каннабидиол усиливает передачу сигналов анандамида и облегчает психотические симптомы при шизофрении. Трансляционная психиатрия. 2012;2:e94. doi: 10.1038/tp.2012.15.69. [DOI] [Бесплатная статья в журнале PMC] [PubMed] [Google Scholar]
- Лигрести А., Де Петрочеллис Л., Ди Марцо В. От фитоканнабиноидов к каннабиноидным рецепторам и эндоканнабиноидам: плейотропные физиологические и патологические роли в рамках комплексной фармакологии. Physiol Rev. 2016;96:1593–659. doi: 10.1152/physrev.00002.2016.70. [DOI] [PubMed] [Google Scholar]
- Лигрести А., Скьяно Мориэлло А., Старович К., Матиас И., Пизанти С., Де Петрочеллис Л. и др. Противоопухолевая активность растительных каннабиноидов с акцентом на влияние каннабидиола на карциному молочной железы человека. J Pharmacol Exp Ther. 2006;318:1375–87. doi: 10.1124/jpet.106.105247.71. [DOI] [PubMed] [Google Scholar]
- Лория Ф., Петрозино С., Эрнангомес М., Местре М., Спаньоло А., Корреа Ф. и др. Эндоканнабиноидный тонус ограничивает эксайтотоксичность in vitro и на модели рассеянного склероза. Neurobiol Dis. 2010;37:166–76. doi: 10.1016/j.nbd.2009.09.020.72. [DOI] [PubMed] [Google Scholar]
- Мареш К., Кэрриер Э. Дж., Пономарев Е. Д., Хиллард С. Дж., Диттел Б. Н. Модуляция рецептора каннабиноида CB2 в клетках микроглии в ответ на воспалительные стимулы. J Neurochem. 2005;95:437–45. doi: 10.1111/j.1471-4159.2005.03380.x.73. [DOI] [PubMed] [Google Scholar]
- Масси П., Ваккани А., Бьянесси С., Коста Б., Макки П., Пароларо Д. Непсихоактивный каннабидиол вызывает активацию каспаз и окислительный стресс в клетках глиомы человека. Cell Mol Life Sci. 2006;63:2057–66. doi: 10.1007/s00018-006-6156-x.74. [DOI] [Бесплатная статья в журнале PMC] [PubMed] [Google Scholar]
- Мато С., Санчес-Гомес М. В., Матуте С. Каннабидиол вызывает повышение уровня внутриклеточного кальция и цитотоксичность в олигодендроцитах. Glia. 2010;58:1739–47. doi: 10.1002/glia.21044.75. [DOI] [PubMed] [Google Scholar]
- Макаллистер С.Д., Мурасе Р., Кристиан Р.Т., Лау Д., Зелински А.Дж., Эллисон Дж. и др. Механизмы, опосредующие влияние каннабидиола на снижение пролиферации, инвазии и метастазирования клеток рака молочной железы. Исследования и лечение рака молочной железы. 2011;129:37–47. doi: 10.1007/s10549-010-1177-4.76. [DOI] [Бесплатная статья в PMC] [PubMed] [Google Scholar]
- Макхью Д., Пейдж Дж., Данн Э., Брэдшоу Х. Б. Дельта(9)-тетрагидроканнабинол и N-арахидонилглицин являются полными агонистами рецепторов GPR18 и вызывают миграцию клеток HEC-1B эндометрия человека. Br J Pharmacol. 2012;165:2414–24. doi: 10.1111/j.1476-5381.2011.01497.x.77. [DOI] [Бесплатная статья в журнале PMC] [PubMed] [Google Scholar]
- Меча М., Фелиу А., Каррильо-Салинас Ф., Гуаса К. Справочник по каннабису и связанным с ним патологиям. Издательство Elsevier; 2017. С. 893–904.78. [Google Scholar]
- Меха М., Торрао А. С., Местре Л., Каррильо-Салинас Ф. Дж., Мешулам Р., Гуаза К. Каннабидиол защищает клетки-предшественники олигодендроцитов от апоптоза, вызванного воспалением, ослабляя стресс эндоплазматического ретикулума. Cell Death Dis. 2012;3:e331. doi: 10.1038/cddis.2012.71.79. [DOI] [Бесплатная статья в PMC] [PubMed] [Google Scholar]
- Мешулам Р., Браун П., Гаони Я. А. Стереоспецифический синтез (-)-дельта-1- и (-)-дельта-1(6)-тетрагидроканнабинолов. J Am Chem Soc. 1967;89:4552–4. doi: 10.1021/ja00993a072.80. [DOI] [PubMed] [Google Scholar]
- Мешулам Р., Шво И., Хашиш И. Структура каннабидиола. Тетраэдр. 1963;19:2073–8. doi: 10.1016/0040-4020(63)85022-x.81. [DOI] [PubMed] [Google Scholar]
- Нестлер Э. Дж., Баррот М., ДиЛеоне Р. Дж., Эйш А. Дж., Голд С. Дж., Монтеджиа Л. М. Нейробиология депрессии. Neuron. 2002;34:13–25. doi: 10.1016/s0896-6273(02)00653-0.82. [DOI] [PubMed] [Google Scholar]
- Окли Дж. К., Калум Ф., Каттералл У. А. Понимание патофизиологии и методов лечения на примере мышиной модели синдрома Драве. Эпилепсия. 2011;52:59–61. doi: 10.1111/j.1528-1167.2011.03004.x.83. [DOI] [Бесплатная статья в журнале PMC] [PubMed] [Google Scholar]
- Паготто У., Марсикано Дж., Кота Д., Лутц Б., Паскуали Р. Растущая роль эндоканнабиноидной системы в эндокринной регуляции и энергетическом балансе. Endocr Rev. 2006;27:73–100. doi: 10.1210/er.2005-0009.84. [DOI] [PubMed] [Google Scholar]
- Pertwee R. Фармакологические и терапевтические мишени для Δ9-тетрагидроканнабинола и каннабидиола. Euphytica. 2004;140:73.85. [Google Scholar]
- Pertwee RG. Фармакология каннабиноидных рецепторов CB1 и CB2. Pharmacol Ther. 1997;74:129–80. doi: 10.1016/s0163-7258(97)82001-3.86. [DOI] [PubMed] [Google Scholar]
- Pertwee RG. Новые стратегии применения агонистов каннабиноидных рецепторов в качестве лекарственных средств. Br J Pharmacol. 2009;156:397–411. doi: 10.1111/j.1476-5381.2008.00048.x.87. [DOI] [Бесплатная статья в PMC] [PubMed] [Google Scholar]
- Pertwee RG. Разнообразие фармакологических свойств рецепторов CB1 и CB2 у трёх растительных каннабиноидов: Δ9-тетрагидроканнабинола, каннабидиола и Δ9-тетрагидроканнабиварина. Br J Pharmacol. 2008;153:199–215. doi: 10.1038/sj.bjp.0707442.88. [DOI] [Бесплатная статья в PMC] [PubMed] [Google Scholar]
- Петтит Дэд, Харрисон ЭмПи, Олсон Джей Эм, Спенсер Эр Фэ, Кабрал Гэ Эй. Иммуногистохимическая локализация нейронного каннабиноидного рецептора в головном мозге крысы. J. Neurosci Res. 1998;51:391–402. doi: 10.1002/(SICI)1097-4547(19980201)51:3<391::AID-JNR12>3.0.CO;2-A.89. [DOI] [PubMed] [Google Scholar]
- Портелла Дж., Лаэцца К., Лаккетти П., Де Петрочеллис Л., Ди Марцо В., Бифулько М. Ингибирующее действие стимуляции каннабиноидных рецепторов CB1 на рост опухоли и распространение метастазов: влияние на сигналы, участвующие в ангиогенезе и метастазировании. FASEB J. 2003;17:1771–3. doi: 10.1096/fj.02-1129fje.90. [DOI] [PubMed] [Google Scholar]
- Рабинак К.А., Ангштадт М., Шрипада К.С., Абельсон Дж.Л., Либерзон И., Милад М.Р. и др. Влияние каннабиноидов на восстановление памяти об угасании страха у людей. Нейрофармакология. 2013;64:396–402. doi: 10.1016/j.neuropharm.2012.06.063.91. [DOI] [Бесплатная статья в PMC] [PubMed] [Google Scholar]
- Рамирес Б. Г., Бласкес К., Гомес дель Пульгар Т., Гусман М., де Себальос М. Л. Профилактика патологии болезни Альцгеймера с помощью каннабиноидов: нейропротекция, опосредованная блокадой активации микроглии. J Neurosci. 2005;25:1904–13. doi: 10.1523/JNEUROSCI.4540-04.2005.92. [DOI] [Бесплатная статья в PMC] [PubMed] [Google Scholar]
- Ри К., Рош М., Финн Д. П. Супраспинальная модуляция боли каннабиноидами: роль ГАМК и глутамата. Британский журнал фармакологии. 2007;152:633–48. doi: 10.1038/sj.bjp.0707440.93. [DOI] [Бесплатная статья в журнале PMC] [PubMed] [Google Scholar]
- Рог Д. Дж., Нурмикко Т. Дж., Янг К. А. Оромукозальный Δ9-тетрагидроканнабинол/каннабидиол при нейропатической боли, связанной с рассеянным склерозом: неконтролируемое открытое исследование с двухлетним продолжением. Clin Ther. 2007;29:2068–79. doi: 10.1016/j.clinthera.2007.09.013.94. [DOI] [PubMed] [Google Scholar]
- Рог Д. Дж., Нурмикко Т. Дж., Фриде Т., Янг К. А. Рандомизированное контролируемое исследование применения препаратов на основе каннабиса при центральной боли при рассеянном склерозе. Неврология. 2005;65:812–9. doi: 10.1212/01.wnl.0000176753.45410.8b.95. [DOI] [PubMed] [Google Scholar]
- Ройтман П., Мешулам Р., Купер-Казаз Р., Шалев А. Предварительное открытое пилотное исследование дополнительного перорального приема δ9-тетрагидроканнабинола при хроническом посттравматическом стрессовом расстройстве. Клинические исследования лекарственных средств. 2014;34:587–91. doi: 10.1007/s40261-014-0212-3.96. [DOI] [PubMed] [Google Scholar]
- Ромиджи А., Бари М., Плачиди Ф., Марчиани М. Г., Малапонти М., Торелли Ф. и др. Уровни эндоканнабиноида анандамида в спинномозговой жидкости снижены у пациентов с недавно диагностированной височной эпилепсией, не получающих лечения. Эпилепсия. 2010;51:768–72. doi: 10.1111/j.1528-1167.2009.02334.x.97. [DOI] [PubMed] [Google Scholar]
- Ронези Дж., Ловингер Д. М. Индукция долговременной синаптической депрессии в полосатом теле путём умеренной частотной активации кортикальных афферентов у крыс. Журнал физиологии. 2005;562:245–56. doi: 10.1113/jphysiol.2004.068460.98. [DOI] [Бесплатная статья в журнале PMC] [PubMed] [Google Scholar]
- Сагредо О., Гонсалес С., Аройо И., Пасос М. Р., Бенито С., Ластрес-Беккер И. и др. Агонисты каннабиноидных рецепторов CB2 защищают полосатое тело от токсического воздействия малоната: актуально для болезни Гентингтона. Glia. 2009;57:1154–67. doi: 10.1002/glia.20838.99. [DOI] [Бесплатная статья в PMC] [PubMed] [Google Scholar]
- Сагредо О., Рамос Х. А., Децио А., Мешулам Р., Фернандес-Руис Х. Каннабидиол уменьшает атрофию полосатого тела, вызванную 3-нитропропионовой кислотой, in vivo за счёт механизмов, не связанных с активацией каннабиноидных, ваниллоидных TRPV1 и аденозиновых A2A рецепторов. Eur J Neurosci. 2007;26:843–51. doi: 10.1111/j.1460-9568.2007.05717.x.100. [DOI] [PubMed] [Google Scholar]
- Салазар М., Карраседо А., Салануэва И. Дж., Эрнандес-Тидра С., Эгиа А., Лоренте М. и др. TRB3 связывает стресс эндоплазматического ретикулума с аутофагией при противоопухолевом действии каннабиноидов. Аутофагия. 2009;5:1048–9. doi: 10.4161/auto.5.7.9508.101. [DOI] [PubMed] [Google Scholar]
- Салазар М., Карраседо А., Салануэва И. Дж., Эрнандес-Тидра С., Лоренте М., Эгиа А. и др. Действие каннабиноидов вызывает опосредованную аутофагией гибель клеток за счет стимуляции стресса эндоплазматического ретикулума в клетках глиомы человека. J Clin Invest. 2009;119:1359–72. doi: 10.1172/JCI37948.102. [DOI] [Бесплатная статья в PMC] [PubMed] [Google Scholar]
- Сано К., Мисима К., Коуши Э., Орито К., Эгасира Н., Ирие К. и др. Каталептическая обездвиженность, вызванная дельта(9)-тетрагидроканнабинолом, обусловлена снижением нейротрансмиссии 5-HT в прилежащем ядре из-за действия глутаматсодержащих нейронов. Нейронаука. 2008;151:320–8. doi: 10.1016/j.neuroscience.2007.10.026.103. [DOI] [PubMed] [Google Scholar]
- Шультес Р. Э. Человек и марихуана. Nat Hist. 1973;82:59.104. [Google Scholar]
- Шультес Р. Э. Галлюциногены растительного происхождения. Science. 1969;163:245–54. doi: 10.1126/science.163.3864.245.105. [DOI] [PubMed] [Google Scholar]
- Шурман Л. Д., Лихтман А. Х. Эндоканнабиноиды: многообещающее средство для лечения черепно-мозговых травм. Front Pharmacol. 2017;8:69. doi: 10.3389/fphar.2017.00069.106. [DOI] [Бесплатная статья в журнале PMC] [PubMed] [Google Scholar]
- Шах А., Каррено Ф. Р., Фрейзер А. Методы лечения резистентной депрессии: фокус на стимуляции блуждающего нерва и кетамине. Clin Psychopharmacol Neurosci. 2014;12:83–93. doi: 10.9758/cpn.2014.12.2.83.107. [DOI] [Бесплатная статья в журнале PMC] [PubMed] [Google Scholar]
- Sheline YI, West T, Yarashesk KI, Swarm R, Jasielec MS, Fisher JR, et al. Антидепрессант снижает выработку бета-амилоида в спинномозговой жидкости у здоровых людей и у трансгенных мышей с болезнью Альцгеймера. Sci Transl Med. 2014;6:236re4. doi: 10.1126/scitranslmed.3008169.108. [DOI] [Бесплатная статья в PMC] [PubMed] [Google Scholar]
- Шохами Э., Коэн-Йешурун А., Магид Л., Алгали М., Мешулам Р. Эндоканнабиноиды и черепно-мозговая травма. Br J Pharmacol. 2011;163:1402–10. doi: 10.1111/j.1476-5381.2011.01343.x.109. [DOI] [Бесплатная статья в журнале PMC] [PubMed] [Google Scholar]
- Зингер Э., Джадкинс Дж., Саломонис Н., Матлаф Л., Сотеропулос П., Макаллистер С. и др. Терапевтический ответ и резистентность при глиобластоме, опосредованные активными формами кислорода. Cell Death Dis. 2015;6:e1601. doi: 10.1038/cddis.2014.566.110. [DOI] [Бесплатная статья в журнале PMC] [PubMed] [Google Scholar]
- Солинас М., Масси П., Кантельмо А. Р., Каттанео М. Г., Каммарота Р., Бартолини Д. и др. Каннабидиол подавляет ангиогенез с помощью различных механизмов. Br J Pharmacol. 2012;167:1218–31. doi: 10.1111/j.1476-5381.2012.02050.x.111. [DOI] [Бесплатная статья в PMC] [PubMed] [Google Scholar]
- Стерн К.А.Дж., Газарини Л., Ванвоссен А.С., Зуарди А.В., Гальве-Ропер И., Гимарайнш Ф.С. и др. Дельта(9)-тетрагидроканнабинол сам по себе и в сочетании с каннабидиолом ослабляет память о страхе за счёт нарушения реконсолидации. Eur Neuropsychopharmacol. 2015;25:958–65. doi: 10.1016/j.euroneuro.2015.02.001.112. [DOI] [PubMed] [Google Scholar]
- Штерн К.А., Газарини Л., Такахаси Р.Н., Гимарайнш Ф.С., Бертольо Л.Дж. О нарушении памяти страха при блокировке реконсолидации: данные о лечении каннабидиолом. Нейропсихофармакология. 2012;37:2132–42. doi: 10.1038/npp.2012.63.113. [DOI] [Бесплатная статья в журнале PMC] [PubMed] [Google Scholar]
- Урибе-Мариньо А., Франсиско А., Кастибланко-Урбина М. А., Твардовски А., Сальгадо-Ронер С. Дж., Криппа Дж. и др. Антиаверсивное действие каннабидиола на поведение, вызванное врождённым страхом, в этологической модели панических атак, основанной на парадигме конфронтации «жерт против дикой змеи Epicrates cenchria crassus». Нейропсихофармакология. 2012;37:412–21. doi: 10.1038/npp.2011.188.114. [DOI] [Бесплатная статья в журнале PMC] [PubMed] [Google Scholar]
- Вальдеоливас С., Сатта В., Пертви Р. Г., Фернандес-Руис Х., Сагредо О. Комбинация фитоканнабиноидов, подобная сативексу, оказывает нейропротекторное действие на крыс с малановым повреждением — воспалительной моделью болезни Гентингтона: роль рецепторов CB1 и CB2. ACS Chem Neurosci. 2012;3:400–6. doi: 10.1021/cn200114w.115. [DOI] [Бесплатная статья в PMC] [PubMed] [Google Scholar]
- Ван Дер Стелт М., Маццола К., Эспозито Дж., Матиас И., Петрозино С., Де Филиппис Д. и др. Эндоканнабиноиды и нейротоксичность, вызванная бета-амилоидом, in vivo: влияние фармакологического повышения уровня эндоканнабиноидов. Cell Mol Life Sci. 2006;63:1410–24. doi: 10.1007/s00018-006-6037-3.116. [DOI] [Бесплатная статья в журнале PMC] [PubMed] [Google Scholar]
- Веленовска М., Фисар З. Влияние каннабиноидов на поглощение серотонина тромбоцитами. Addict Biol. 2007;12:158–66. doi: 10.1111/j.1369-1600.2007.00065.x.117. [DOI] [PubMed] [Google Scholar]
- Voth EA. Руководство по назначению медицинской марихуаны. West J Med. 2001;175:305–6. doi: 10.1136/ewjm.175.5.305.118. [DOI] [Бесплатная статья в PMC] [PubMed] [Google Scholar]
- 119.Wada.-ama.org. Международный стандарт Всемирного антидопингового кодекса: запрещенный список. 2018. Январь, [по состоянию на 29 января 2018 года]. Доступно по ссылке: https://www.wada-ama.org/sites/default/files/prohibited_list_2018_en.pdf .
- Уэйд Д. Т., Макела П., Робсон П., Хаус Х., Бейтман К. Оказывают ли лекарственные экстракты на основе каннабиса общее или специфическое воздействие на симптомы рассеянного склероза? Двойное слепое рандомизированное плацебо-контролируемое исследование с участием 160 пациентов. Mult Scler. 2004;10:434–41. doi: 10.1191/1352458504ms1082oa.120. [DOI] [PubMed] [Google Scholar]
- Вальтер С., Мальберг Р., Эйхманн У., Кунц Д. Дельта-9-тетрагидроканнабинол при ночном возбуждении у пациентов с тяжелой деменцией. Психофармакология. 2006;185:524–8. doi: 10.1007/s00213-006-0343-1.121. [DOI] [PubMed] [Google Scholar]
- Ван Ц., Шао Ф., Ван В. Разлучение с матерью приводит к изменениям в экспрессии нейротрофического фактора головного мозга у крыс разного возраста. Front Mol Neurosci. 2015;8:49. doi: 10.3389/fnmol.2015.00049.122. [DOI] [Бесплатная статья в журнале PMC] [PubMed] [Google Scholar]
- Ви Н., Кандиа Н., Ачарья С., Чандер Р. Дж., Нг А., Ау У. Л. и др. Депрессия и тревожность сопутствуют болезни Паркинсона легкой степени, но могут проявляться по отдельности: проспективное лонгитюдное исследование закономерностей и предикторов. Паркинсонизм и связанные с ним расстройства. 2016;23:50–6. doi: 10.1016/j.parkreldis.2015.12.001.123. [DOI] [PubMed] [Google Scholar]
- Уолли Б. Дж. Каннабис в профилактике и лечении судорог и эпилепсии: научный обзор. Предварительная публикация для распространения в открытом доступе. Американская фармакопея лекарственных растений. 2014 г., 12 марта;124. [Google Scholar]
- Уилсон Р. И., Николл Р. А. Эндогенные каннабиноиды опосредуют ретроградную передачу сигналов в синапсах гиппокампа. Nature. 2001;410:588–92. doi: 10.1038/35069076.125. [DOI] [PubMed] [Google Scholar]
- Зайчек Дж., Фокс П., Сандерс Х., Райт Д., Викери Дж., Нанн А. и др. Каннабиноиды для лечения спастичности и других симптомов, связанных с рассеянным склерозом (исследование CAMS): многоцентровое рандомизированное плацебо-контролируемое исследование. Lancet. 2003;362:1517–26. doi: 10.1016/S0140-6736(03)14738-1.126. [DOI] [PubMed] [Google Scholar]
- Zajicek JP, Sanders HP, Wright DE, Vickery PJ, Ingram WM, Reilly SM, et al. Исследование каннабиноидов при рассеянном склерозе (CAMS): данные о безопасности и эффективности за 12 месяцев наблюдения. Журнал неврологии, нейрохирургии и психиатрии. 2005;76:1664–9. doi: 10.1136/jnnp.2005.070136.127. [DOI] [Бесплатная статья в PMC] [PubMed] [Google Scholar]
- Чжан К., Цзян Х., Чжан Ц., Ду Дж., Ван Ю., Чжао М. Уровень нейротрофического фактора головного мозга в сыворотке крови у пациентов с героиновой зависимостью после 26 недель абстиненции. Compr Psychiatry. 2016;65:150–5. doi: 10.1016/j.comppsych.2015.11.010.128. [DOI] [PubMed] [Google Scholar]
- Жорницкий С., Потвин С. Каннабидиол в организме человека — в поисках терапевтических мишеней. Фармацевтика. 2012;5:529–52. doi: 10.3390/ph5050529.129. [DOI] [Бесплатная статья в PMC] [PubMed] [Google Scholar]